 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| работа совершаемая идеальным газом
Первое начало термодинамики Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь ее внутренняя энергия. Внутренняя энергия системы может изменяться в результате различных процессов, например совершения над системой работы и сообщения ей теплоты. первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. Q=ΔU+A в дифференциальной форме будет иметь вид dQ=dU+dA, или в более корректной форме δQ=dU+δA где dU — бесконечно малое изменение внутренней энергии системы, δА — элементарная работа, δQ — бесконечно малое количество теплоты. В этом выражении dU является полным дифференциалом, а δA и δQ таковыми не являются. В дальнейшем будем использовать запись первого начала термодинамики в форме. Изохорный процесс (V = const). Диаграмма этого процесса (изохора) в координатах р, V изображается прямой, параллельной оси ординат (рис. 81), где процесс 1—2 есть изохорное нагревание, а 1—3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е. δA=pdV = 0. Как уже указывалось в § 53, из первого начала термодинамики (δQ=dU+δA) для изохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии: δQ =dU Согласно формуле (53.4), dUm = CvdT. Тогда для произвольной массы газа получим
Изобарный процесс (р=const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, параллельной оси V. При изобарном процессе работа газа (см. (52.2)) при расширении объема от V1 до V2 равна изобарный
Изотермический
28 Адиабати́ческий, или адиаба́тный проце́сс (от др.-греч. ἀδιάβατος — «непроходимый») — термодинамический процесс в макроскопической системе, при котором система не обменивается тепловой энергией с окружающим пространством Если термодинамический процесс в общем случае являет собой три процесса — теплообмен, совершение системой (или над системой) работы и изменение её внутренней энергии, то адиабатический процесс в силу отсутствия теплообмена ( где U— изменение внутренней энергии тела, A — работа, совершаемая системой. Изменения энтропии S системы в обратимом адиабатическом процессе вследствие передачи тепла через границы системы не происходит: Здесь T — температура системы, Q — теплота, полученная системой. Благодаря этому адиабатический процесс может быть составной частью обратимого цикла.
Внутренняя энергия
Внутренняя энергия является однозначной функцией состояния системы. Поэтому применительно к адиабатическому процессу её изменение имеет тот же физический смысл, что и в общем случае. Согласно закону Джоуля где —V число молей идеального газа.
работа совершаемая идеальным газом ИДЕАЛЬНЫЙ ГАЗ Идеализированная модель газа; в идеальном газе силы взаимодействия между частицами (атомами, молекулами) пренебрежимо малы. К идеальному газу близки разреженные реальные газы при температурах, далеких от температуры их конденсации. Зависимость давления идеального газа от его температуры и плотности выражается Клапейрона уравнением. Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами. Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
|














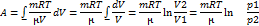

 ) системы со средой сводится только к последним двум процессам. Поэтому, первое начало термодинамики в этом случае приобретает вид
) системы со средой сводится только к последним двум процессам. Поэтому, первое начало термодинамики в этом случае приобретает вид 

 , выведенному экспериментально, внутренняя энергия идеального газа ,Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. не зависит от давления или объёма газа. Исходя из этого факта, можно получить выражение для изменения внутренней энергии идеального газа. По определению молярной теплоёмкости при постоянном объёме, [14].
, выведенному экспериментально, внутренняя энергия идеального газа ,Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. не зависит от давления или объёма газа. Исходя из этого факта, можно получить выражение для изменения внутренней энергии идеального газа. По определению молярной теплоёмкости при постоянном объёме, [14].  Иными словами — это предельное соотношение изменения внутренней энергии и породившего его изменения температуры. При этом, по опредленению частной производной считается только то изменение внутренней энергии, которое порождено именно изменением температуры, а не другими сопутствующими процессами. Так как внутренняя энергия идеального газа является функцией только температуры, то
Иными словами — это предельное соотношение изменения внутренней энергии и породившего его изменения температуры. При этом, по опредленению частной производной считается только то изменение внутренней энергии, которое порождено именно изменением температуры, а не другими сопутствующими процессами. Так как внутренняя энергия идеального газа является функцией только температуры, то  (2)
(2)