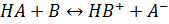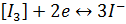ПОЗНАВАТЕЛЬНОЕ
| Методи осадження. Аргентометрія
Методи осадження ґрунтуються на утворенні при титруванні малорозчиних речовин, які випадають в осад. Для кількісних розрахунків за цими методами необхідно визначити об’єм титранту, який витрачається на повне осадження досліджуваної речовини. Осад повинен відповідати таким вимогам: 1. Осад має бути практично нерозчинним. 2. Утворення осаду має відбуватися швидко. 3. Реакції осадження мають перебігати кількісно у відповідності зі стехіометрією хімічного рівняння. 4. Має бути можливість вибору індикатора до відповідної реакції осадження. 5. На результати титрування не повинні впливати явища адсорбції. Найбільшою мірою цим умовам відповідають реакції утворення осадів ряду аніонів з солями ряду аніонів з солями аргентуму, на яких ґрунтується метод аргентометрії. За цим методом визначають хлорид-, бромід-, тіоціанід-іони. Наприклад: Визначення хлоридів (індикатор калію хромат, забарвлення цегельно червоний осад аргентуму хромату).
Умови титрування: середовище близьке до нейтрального (pH 6,3-10,0).У кислому середовищі калію хромат перетворюється у дихромат:
При pH>10,0 можливе протікання реакції:
2.1.4 Комплекосонометрія В аналітичній практиці широке застосування знаходить компексонометрія-титрометричний метод аналізу, який ґрунтується на утворенні стійких комплексних сполук катіонів полівалентних металів з різноманітними лігандами. До комплекксиметрії належить меркуриметрія – титрування солями Точку еквівалетності у комплексонометричному титруванні можна встановити за допомогою фізичних методів ( потенціометрично, амперометричний) однак на практиці відають перевагу візуальному індикаторному способу, як найбільш простому, зручному та швидкому. Індикатори , які використовують у комплексонометрії, називають металоіндикаторами. Метало індикатори – це органічні барвники які утворюють з іонами металів інтенсивно забарвлені комплекси. При цьому більшість індикаторів приєднують або віддають протони, змінючи при цьому забарвлення.
2.1.5 Кислотно-основне титрування Метод кислотно-основного титрування ґрунтується на реакціях кислотно-основної взаємодії, які в загальному вигляді можна представити таким чином:
Сила кислоти або основи значною мірою залежить від кислотно-основних властивостей розчинника. Розчинення багатьох речовин можна представити як реакції утворення супряжених кислот і основи:
Сила кислоти у водному розчині визначається тим, наскільки повно вона віддає протони молекулам води, а сила онови – наскільки вона акцептує протони молекул води. Кислотно основне титрування включає в себе Алкаліметрію в водном і безводном середовищі В водном визначення HCl s=1
Ацидиметрія ацидиметричні методи титрування у фармацевтичному аналізі використовують для визначення органічних основ або солей утворених сильними основами та слабкоми кислотами. Неподілена електрона пара нітрогену зазвичай підбирають індикатор з переходом забарвлення в кислому середовищі: метиловий оранжевий , метиловий червоний. Визначення аміаку розчину конц.
S=1 Зворотна ацидиметрія Індикатор – який має перехід в слабкокислому середовищі, що відповідає рН гідролізу продукту реакції- Амонію хлориду. 2.1.6 Методи окислення-відновлення Методи окисно-відновного титрування ґрунтуються на використанні процесів, повязаних з переносом електронів, тобто окисно-відновних реакцій Це дуже розповсюджені методи титриметричного аналізу, що дозволяють прямо або зворотно визначати неорганічні лікарські речовини, здатні за певних умов стехіометрично приймати або відавати елекрони, тобто бути окиснені до речовин з менш ступенем відновлення, ніж віхідні речовини. У методах окисно-відновного титрування використовують пряме,зворотне, та титрування за замісником. Пряме титрування використовують у тих випадках коли швидкість реакції досить швидко. Зворотне титрування використовують, якщо реакція перебігає повільно та для її завершення потрібний час, а також для визначення летких сполук та тих, що прямо не реагують з титрантом. Титрування за замісником використовують у тих випадках, коли досліджувана речовина не реагуює з титрантом або реакція перебігає не стехіометрично. Кінцеву точку титрування в окисно –відновних методах визначають безідикаторним методом або за допомогою специфічних та редок- індикаторів. -Перманганатометрія Метод грунтується на застосуванні реакцій окиснення лікарської речовини, що визначається, перманганат іонами. Продукти відновлення перманганат-іонів можуть бути різними залежно від рН середовища: - У сильно кислому середовищі:
- У слабкокислому або нейтральному середовищі:
- У слабколужном середовищі:
Для створення кислого середовища застосовують сульфатну кислоту. Даний метод є безіндикаторним титрування проводять до знебарвлення розчину. Визначають Перманганатометрично Розчин водню пероксиду 3%
Йодометрія Йодометрія – метод кількісного визначення вільного йоду або тих речовин, які кількісно виділяють його під час реакцій, і тих сполук, які зв’язують йод або окислюються йодом у стехіометричних кількостях. Йодометричний метод кількісного визначення має широке ппрактичне застосування; за своєю природою і точністю він визнається одним із кращих редокс-методів кількісного визначення. В основі йодометричного визначення лежать реакції
Йод здатний вступати в реакції приєднання, які використовується 12 |



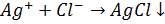


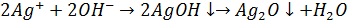
 , меркурометрія – титрування солями
, меркурометрія – титрування солями 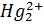 .
.