 ПОЗНАВАТЕЛЬНОЕ
| Гальванічні елементи. Корозія металів
Електрохімія вивчає процеси перетворення хімічної енергії в електричну і навпаки. Електрохімія розглядає виникнення електричного потенціалу на межі поділу двох фаз метал – розчин, утворення електрорушійної сили (ЕРС) у гальванічних елементах, а також явище електролізу. Гальванічний елемент – це прилад, в якому енергія окислювально-відновної реакції перетворюється безпосередньо в електричну. Прикладом може бути гальванічний мідно-цинковий елемент (елемент Якобі–Даніеля, див. рис.1 на с.18), (-)Zn½ZnSO4½½CuSO4½Cu (+) Двома вертикальними рисками позначено межу поділу розчинів обох солей. У цьому елементі цинковий електрод є анодом, а мідний – катодом. На аноді відбувається окислення (Zn - 2е-=Zn2+), на катоді – відновлення (Cu2++2е-=Cu). Сумарна реакція Zn+Cu2+=Zn2++Cu є джерелом електричного струму. Електрорушійну силу (ЕРС) гальванічного елемента визначають як різницю електродних потенціалів. При цьому від потенціалу катода віднімають потенціал анода: ЕРС=Eкатода-Eанода (3) Приклад 2. Обчислити ЕРС гальванічного елемента Якобі-Даніеля, якщо концентрація розчину ZnSO4 - 0,1 моль/л, а розчину CuSO4 - 2 моль/л. Розв’язання. Знаходимо потенціал мідного електрода (катода):
Знаходимо потенціал цинкового електрода (анода):
Знаходимо ЕРС елемента: ЕРС=0,35 - (-0,79)=1,14 В. Гальванічний елемент, що складається із двох однакових електродів, занурених у розчин однорідної солі різних концентрацій, називається концентраційним елементом. (-)Ag½AgNO3½½AgNO3½Ag (+) C2 C1 У концентраційних елементах катодом є електрод, що має більшу концентрацію солі C1, анодом – електрод з меншою концентрацією солі C2. ЕРС таких елементів обчислюють за рівнянням:
До окислювально-відновних відносять гальванічні елементи, в яких реакція окислення або відновлення проходить у розчині без участі матеріалу електрода, останній служить лише провідником електронів. Прикладом окислювально-відновного електрода може бути платина, занурена в розчин солей FeCl2 і FeCl3. Якщо такий електрод з’єднати з будь-яким іншим у замкнутий елемент, то в ньому проходитиме реакція окислення-відновлення. Fe3++e-=Fe2+ Потенціал такого електрода обчислюють за формулою:
де [oxyd], [red] - концентрація відповідно окисленої і відновленої форми. Катод – це електрод, на якому відбуваються відновні процеси. Анод – це електрод, на якому проходять окислювальні процеси. У гальванічних елементах катод має позитивний знак /+/; анод – негативний /-/. При електролізі катод негативний, анод – позитивний. У гальванічних елементах електродний потенціал катода завжди більший, ніж анода. Приклад 3. Визначити катод і анод для таких двох металів: а) цинк – срібло; б) цинк – магній. Привести схеми цих елементів. Розв’язання. а) б) Схеми таких елементів: а) (-) Zn ½Zn2+ ½½Ag+ ½Ag (+) б) (-) Mg½Mg2+½½Zn2+½Zn (+) Корозія – це процес руйнування металу внаслідок хімічної або електрохімічної взаємодії його з навколишнім середовищем: повітрям, водою, газами, розчинами кислот, лугів і солей. Розрізняють хімічну й електрохімічну корозії. В основі хімічної корозії лежать звичайні хімічні реакції утворення оксидів і солей у середовищах, що не проводять електричного струму (гази при високих температурах, нафтопродукти, мастила, продукти термічної деструкції полімерів). Електрохімічна корозія виникає в системах, що проводять електричний струм у тих випадках, коли самовільно утворюються гальванічні елементи. Прикладом електрохімічної корозії є корозія чавуну і сталі у вологому середовищі: залізо іржавіє тому, що утворюються гальванічні елементи, в яких катодами є ділянки карбіду заліза Fe3C: (-) Fe ½H2O, O2½ Fe3C (+) На анодних ділянках окислюється залізо: Fe – 2e-= Fe2+ На катодних - відбувається відновлення: 2H2O+O2+4e-=4OH- Внаслідок вторинних процесів: Fe2++2OH-=Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe(OH)3=H2O+FeO(OH) утворюється іржа – суміш нерозчинних продуктів - гідроксидів Fe(OH)2, Fe(OH)3 і оксигідроксидів заліза FeO(OH). Приклад 4. Написати схеми гальванічних елементів, що утворюються при контактній корозії заліза, покритого цинком, і заліза, покритого оловом. Розв’язання. У першому випадку утворюється гальванічний елемент (-) Zn ½H2O, O2½ Fe (+) в результаті роботи якого руйнується цинк на анодних ділянках: Zn – 2e-= Zn2+ На катодних ділянках утворюються гідроксид-іони: 2H2O+O2+4e-=4OH- Утворення гідроксиду цинку – вторинний процес Zn2++2OH-=Zn(OH)2 У другому випадку виникає гальванічний елемент: (-) Fe ½H2O, O2½Sn (+) в результаті роботи якого руйнується залізо на анодних ділянках: Fe – 2e-= Fe2+ На катодних ділянках утворюються гідроксид-іони, а потім бура іржа Fe2++2OH-=Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 У першому випадку цинк окислюється і захищає залізо від корозії (анодний захист); у другому випадку олово захищає залізо, якщо на поверхні заліза утворюється суцільна без тріщин олов’яна плівка (катодний захист). Присутність іонів H+, Cl-, Br-, I-, CN-, Температура досить сильно впливає на швидкість корозії. Як правило, з підвищенням температури швидкість корозії збільшується. Присутність карбонатів, фосфатів і хроматів сповільнює корозію. Велике значення у процесах корозії має склад і мікроструктура металу (чим метал однорідніший, тим корозійна стійкість вища). Для зменшення корозії застосовують різні методи: 1) обробляють навколишнє середовище з метою усунення речовин, які викликають корозію; 2) замінюють повітря (О2) на гелій або інший інертний газ, чи просто створюють вакуум; 3) додають різні інгібітори корозії; 4) створюють захисні плівки (оксидні, масляні, металічні або лакові); 5) вводять у метал компоненти, що підвищують його корозійну стійкість; 6) застосовують протекторний або катодний захист.
Електроліз Електроліз – це окислювально-відновний процес, що відбувається на електродах під час проходження електричного струму крізь розчин чи розплав електроліту. Явище електролізу вперше вивчив і в 1834 р. виклав основні закономірності цього явища у вигляді законів електролізу англійський учений Фарадей. Перший закон Фарадея.При електролізі маса речовини, що виділяється на електродах прямо-пропорційна кількості електричного струму, що проходить крізь розчин або розплав електроліту. m=k×Q (6) Якщо Q =1 Кл, то m=k, тобто k показує, яка маса речовини виділяється на електроді при проходженні 1 Кл електричного струму крізь електроліт, і називається електрохімічним еквівалентом. Відомо, що Q=I×t , отже m=k×I×t (7) де: I - сила електричного струму, А; t - тривалість електролізу, с. Другий закон Фарадея. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин. Для того, щоб виділити на електроді один еквівалент будь-якої речовини, треба затратити 96500 Кл (точніше 96487 Кл) електричного струму. Ця кількість електричного струму називається числом Фарадея і позначається F. Оскільки k=mE(X)/F, то підставляючи вираз k в рівняння (6), отримаємо об’єднаний вираз першого і другого законів Фарадея:
де m(X) –маса речовини, що виділилася на електроді; n - кількість електронів, що беруть участь в електродному процесі (для процесів виділення металів згідно з рівнянням Приклад 5. Обчислити масу міді, що виділилась на катоді, а також масу і об’єм кисню, що виділився на аноді, при електролізі водного розчину CuSO4 з інертним анодом, якщо сила електричного струму – 1 А, тривалість електролізу – 30 хв. (t =27°С, Р=101,3 кПа). Розв’язання. За рівнянням (8) визначимо масу міді, що виділилася на катоді:
Аналогічно визначаємо масу кисню, що виділився на аноді:
Згідно з рівнянням Менделєєва-Клайперона визначаємо об’єм кисню:
Під час електролізу водних розчинів електролітів на катоді в першу чергу відновляються катіони, що мають більш високі значення E0. Якщо потенціал електрода значно менше –0,41 В (наприклад, -1,5 і нижче), то на катоді відновлюються молекули води 2Н2О+2е-=Н2+2ОН- і виділяється водень, а в розчині накопичуються гідроксид-іони; при E0 значно вище –0,41 В (наприклад: -0,15 В і більше) на катоді відновлюються лише іони металу (
2H++2e-=H2(у кислому середовищі) 2H2O+2e-=H2+2OH-(у нейтральному середовищі) Якщо у водному розчині є аніони S2-, I-, Br-, Cl-, OH-, то в першу чергу окиснюються аніони S2-, I-, Br-, Cl-, а OH-- аніони залишаються у розчині. Якщо у водному розчині є аніони у лужному середовищі 4ОН—4e-=2H2O+O2, у нейтральному середовищі 2H2O—4e-=4Н++O2. Приклад 6. Які процеси будуть проходити на катоді і аноді при електролізі водних розчинів FeSO4 і FeCl2 з використанням нерозчинних анодів у нейтральному середовищі? Розв’язання. на катоді: Fe++2e-=Fe0 2H2O+2e-=H2+2OH- на аноді: а) у першому випадку - 2H2O-4e-=4H++O2 б) у другому випадку - 2Cl --2e-=Cl2
2. Лабораторна робота "Загальні властивості металів. Гальванічні елементи. Корозія" Дослід 1. Дослідження активності металів. а)В шість пробірок помістити по 0,5 мл розчинів: в першу – солі цинку, в другу – солі заліза(II) в третю – солі олова(II), в четверту – солі свинцю(II), в п'яту – солі міді(II), в шосту – нітрату срібла. В усі розчини опустити на 3-4 хвилини по шматочку металічного цинку. Що відбувається на поверхні цинку? Написати рівняння реакцій в молекулярній та іонній формі. Повторити дослід з залізом та міддю. Результати спостережень записати в табл.1. Таблиця 1.
В таблиці ставте знак "+" в клітинці йонів, які відновлюються зануреним металом. Розташуйте досліджені метали в порядку зменшення їх активності. б)В три пробірки внести по 1 мл розчину соляної кислоти (1:1). В кожну пробірку внести по шматочку одного із металів: цинку, міді, магнію. Чи всі метали витісняють водень із розчинів кислоти.? Написати рівняння реакцій в молекулярній та йонній формі. Дослід 2. Виготовлення гальванічного елементу.
Дослід 3. Корозія в кислому середовищі.
|



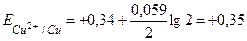 В.
В. В;
В;  В.
В. (4)
(4) (5)
(5) В;
В;  В. Отже цинковий електрод – анод, срібний – катод.
В. Отже цинковий електрод – анод, срібний – катод. В. Таким чином, цинковий електрод буде катодом, а магнієвий – анодом.
В. Таким чином, цинковий електрод буде катодом, а магнієвий – анодом. помітно збільшує швидкість корозії.
помітно збільшує швидкість корозії. (8)
(8) , n - дорівнює зарядові іона Меn+); mE(X) – молярна маса еквівалента речовини (г/моль); M(X) – молярна маса речовини (г/моль); I – сила струму, А; τ – час проходження електролізу, с.
, n - дорівнює зарядові іона Меn+); mE(X) – молярна маса еквівалента речовини (г/моль); M(X) – молярна маса речовини (г/моль); I – сила струму, А; τ – час проходження електролізу, с. г.
г.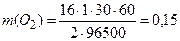 г.
г. м3 =0,115 л
м3 =0,115 л ,
,  -,
-,  -,
-,  , і ОН-, то в першу чергу окиснюються аніони ОН-(Н2О) згідно із загальним рівнянням реакції:
, і ОН-, то в першу чергу окиснюються аніони ОН-(Н2О) згідно із загальним рівнянням реакції: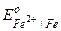 =-0,44 В. Отже, на катоді будуть проходити подвійні процеси:
=-0,44 В. Отже, на катоді будуть проходити подвійні процеси:
 За рис.1 зберіть гальванічний елемент. Для цього одну із склянок заповніть на ¾ розчином сульфату міді (С=1 моль/л), а другу - розчином сульфату цинку (С=1 моль/л). З'єднайте електроліти в склянках електролітичним ключем. Занурте в розчин сульфату цинку - цинкову пластинку, а в розчин сульфату міді – мідну. Під'єднайте ці пластини провідниками до вольтметру, запишіть його показання. Складіть рівняння хімічних реакцій, що протікають на електродах. Розрахуйте електрорушійну силу(е.р.с.) даного елемента, користуючись рядом напруг і рівнянням Нернста, порівняйте її з показаннями вольтметра. Зробіть висновок. Запишіть електрохімічну схему даного гальванічного елемента.
За рис.1 зберіть гальванічний елемент. Для цього одну із склянок заповніть на ¾ розчином сульфату міді (С=1 моль/л), а другу - розчином сульфату цинку (С=1 моль/л). З'єднайте електроліти в склянках електролітичним ключем. Занурте в розчин сульфату цинку - цинкову пластинку, а в розчин сульфату міді – мідну. Під'єднайте ці пластини провідниками до вольтметру, запишіть його показання. Складіть рівняння хімічних реакцій, що протікають на електродах. Розрахуйте електрорушійну силу(е.р.с.) даного елемента, користуючись рядом напруг і рівнянням Нернста, порівняйте її з показаннями вольтметра. Зробіть висновок. Запишіть електрохімічну схему даного гальванічного елемента. Корозія виникає при контакті двох різних металів. В скляну трубку, зігнуту під кутом, налийте розбавлений розчин кислоти (хлоридної чи сульфатної). В одне коліно трубки введіть вузьку пластинку цинку і спостерігайте повільне виділення водню. Введіть в друге коліно мідний дріт, не торкаючись ним до цинку. Чи виділяється водень на міді? Занурте мідний дріт глибше, щоб він торкався цинкової пластинки. Поясніть виділення водню на міді в цьому випадку. Складіть схему дії утвореної гальванопари.
Корозія виникає при контакті двох різних металів. В скляну трубку, зігнуту під кутом, налийте розбавлений розчин кислоти (хлоридної чи сульфатної). В одне коліно трубки введіть вузьку пластинку цинку і спостерігайте повільне виділення водню. Введіть в друге коліно мідний дріт, не торкаючись ним до цинку. Чи виділяється водень на міді? Занурте мідний дріт глибше, щоб він торкався цинкової пластинки. Поясніть виділення водню на міді в цьому випадку. Складіть схему дії утвореної гальванопари.