 ПОЗНАВАТЕЛЬНОЕ
| Загальні властивості металів
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ КАФЕДРА ХІМІЇ
МЕТОДИЧНІ ВКАЗІВКИ
до самостійного вивчення теми та виконання лабораторної роботи «ЗАГАЛЬНІ ТА ЕЛЕКТРОХІМІЧНІ ВЛАСТИВОСТІ МЕТАЛІВ»
для студентів I курсу всіх спеціальностей денної та заочної форм навчання
Кривий Ріг Укладачі: Мовчан В.В., канд. хім. наук, доцент Гостюхин І.А., асистент Мовчан О.Г., канд. хім. наук, доцент
Вiдповiдальний за випуск: Часова Е.В., канд. хім. наук, доцент
Рецензент: Ломовцева С.Б., ст.викладач
Методичні вказівки до самостійного вивчення розділу хімії та до виконання лабораторної роботи «Загальні та електрохімічні властивості металів» для студентів 1 курсу всіх спеціальностей містять основні відомості з теорії електрохімічних процесів, приклади, а також питання для самоконтролю та задачі для самостійного розв’язування.
ЗМІСТ 1. Теоретична частина_ 4 1.1. Загальні властивості металів_ 4 1.2. Гальванічні елементи. Корозія металів_ 11 1.3. Електроліз 15 2. Лабораторна робота "Загальні властивості металів. Гальванічні елементи. Корозія" 18 3. Домашня підготовка до лабораторної роботи_ 19 3.1. Запитання та задачі для самоконтролю_ 19 4. Література_ 21
Теоретична частина
Загальні властивості металів Переважній більшості елементів Періодичної системи (понад 80%) у вільному стані відповідають прості речовини метали. До елементів, які існують у вигляді простих речовин-металів, належать s-елементи І і II груп (окрім Гідрогену), усі d- і f-елементи, а також р-елементи головних підгруп: ІІІ (крім В), ІV (Ge, Sn, Pb), V (Sb, Bi) і VI ( Po) груп. Деяким елементам (Германій, Стибій, Силіцій) відповідають прості речовини, що поєднують металічні властивості з неметалічними. Атоми металів, як правило, мають у зовнішньому електронному шарі 1,2 і значно рідше 3 або 4 електрони та великі атомні радіуси. Метали визначаються здатністю їхніх атомів легко віддавати свої зовнішні (валентні) електрони і перетворюватися на позитивні іони внаслідок низьких значень електронегативностей, які обумовлені невисокими енергіями іонізації атомів і невеликою (часто від'ємною) спорідненістю до електрона. Прості речовини метали. За звичайних умов це тверді речовини кристалічної будови (крім ртуті) з металічним типом зв'язку. Для них характерні: особливий металічний блиск; висока тепло- та електропровідність; пластична деформація. Кристалічні гратки металів складаються з нейтральних атомів і позитивних іонів, які оточені вільними електронами. Рух електронів відбувається хаотично, подібно до руху молекул газу (рис. 1.1).
Рис. 1.1. Схематичне зображення металічних граток Більшість металів кристалізується в одному з трьох типів кристалічної гратки (рис.1.2): щільна гексагональна (Mg, Be, Zn), щільна кубічна гранецентрована (Al, Cu, Ag, Au, Ni, γ-Fe), кубічна об’ємноцентрована (лужні метали, Cr, V, Pb, W, α-Fe).
Рис. 1.2. Кристалічні гратки металів: а- кубічна гранецентрована; б- гексагональна; в - кубічна об’ємноцентрована Хімічні властивості металів. В хімічних процесах атоми металів можуть тільки віддавати електрони, виконуючи відновлювальну функцію: Meo – nе → Men+ Метали як відновники, взаємодіють з окисниками: неметалами (киснем, галогенами, сіркою, азотом, фосфором), водою, кислотами, солями, інколи лугами. Лужні та лужноземельні метали взаємодіють також з воднем:
Відновлювальна здатність різних металів не однакова. Для реакцій в водних розчинах вона визначається положенням металу в електрохімічному ряді напруг (величиною електродного потенціалу). При зануренні металічної пластинки у розчин, який має однойменні іони металу, на межі поділу метал – розчин встановлюється рівновага
виникає подвійний електричний шар, різниця потенціалів в якому і називається електродним потенціалом. Абсолютне значення електродного потенціалу виміряти експериментально або розрахувати теоретично неможливо, тому визначають його відносну величину за допомогою електрода порівняння (водневого, каломельного тощо) чи обчислюють за рівнянням Нернста:
де Для водневого електрода
Концентрація іонів металу обчислюється за рівнянням: [Men+]=С∙ z∙ a де С – молярна концентрація розчину; z - число іонів металу, що утворюються із однієї молекули електроліту; a - ступінь дисоціації, в частках одиниці. Значення стандартних електродних потенціалів відносно водневого електрода визначені при 298 К (25ºС) і зведені в таблиці електродних потенціалів (див. Додаток, с.22). Для будь-якої іншої концентрації електроліту електродний потенціал розраховується за рівняннями (1),(2). Приклад 1. Обчислити потенціал мідного електрода, якщо концентрація CuSO4 – 0,5 моль/л ( Розв’язання. Для електродної реакції Cu2++2е-= Концентрація іонів металу [Cu2+]=0,5 моль/л. Тому
Розмістивши метали у порядку зростання значень їхніх стандартних електродних потенціалів (Додаток, с.22), одержують ряд стандартних електродних потенціалів (електрохімічний ряд напруг металів): |






 ,
, (1)
(1) - стандартне значення електродного потенціалу (при [Men+]=1 моль/л); [Men+] – концентрація іонів металу, моль/л; n – число електронів, що беруть участь в електродному процесі (наприклад, для процесу Fe2++2e-=Fe n=2; для процесу Fe3++e-=Fe2+ n=1); R – універсальна газова стала; T – абсолютна температура; F – число Фарадея.
- стандартне значення електродного потенціалу (при [Men+]=1 моль/л); [Men+] – концентрація іонів металу, моль/л; n – число електронів, що беруть участь в електродному процесі (наприклад, для процесу Fe2++2e-=Fe n=2; для процесу Fe3++e-=Fe2+ n=1); R – універсальна газова стала; T – абсолютна температура; F – число Фарадея. (прийнято в якості міжнародного стандарту). Підставивши в рівняння (1) значення сталих R, F і перейшовши до десяткових логарифмів одержимо (для Т=298 К):
(прийнято в якості міжнародного стандарту). Підставивши в рівняння (1) значення сталих R, F і перейшовши до десяткових логарифмів одержимо (для Т=298 К): (2)
(2)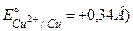 .
. .
. В.
В.