 ПОЗНАВАТЕЛЬНОЕ
| Обработка экспериментальных данных
4.1. По уравнению Клапейрона-Менделеева секундный массовый расход рассчитывается по уравнению состояния идеального газа
4.2. Средняя массовая теплоемкость при р = const и v = const определяется по формуле:
4.3. Средняя объемная теплоемкость для этого же интервала температур:
где плотность при нормальных физических условиях (tн = 0 °C, рн = 0,1013 МПа)
Для воздуха Контрольные вопросы
1. Дайте определение понятию “теплоёмкость тела в данном процессе”. 2. Что называется средней и истинной теплоёмкостью газов? Объяснить с помощью ct - диаграммы. 3. Представить вывод соотношений для определения теплоёмкости cр, cv, 4. Чем отличаются теплоёмкости идеальных и реальных газов? В каких случаях можно принимать теплоёмкость газов величиной постоянной и не зависящей от внешних условий (давления и температуры). 5. Записать выражение для линейной и нелинейной зависимости теплоёмкости от температуры. Объяснить смысл коэффициентов а, b, с. 6. Изложите методику экспериментального определения теплоёмкости методом проточного калориметра. 7. Как определить среднюю теплоёмкость в интервале от t1 до t2 пользуясь таблицами теплоёмкостей от 0 °C до t °C? 8. В чём разница практического определения теплоёмкости газа по формулам истинной и средней теплоёмкости в пределах изменения температуры от t1 до t2? 9. Рассчитать теплоёмкости cр, cv, 10. Написать уравнение для расчёта количества теплоты, выраженное через среднюю теплоёмкость. Представить и объяснить диаграмму сt. 11. Какие преимущества и недостатки молекулярно-кинетической теории. 12. Почему теплоёмкость газа уменьшается при увеличении молекулярной массы? Как это объяснить физически? 13. Объясните физическую причину зависимости теплоемкости реальных газов от давления и температуры? 14. Почему теплоёмкость при р = const больше, чем в процессе v = const. Какими уравнениями связаны между собой эти теплоёмкости? 15. Как определить объемную и массовую теплоёмкости газов по его мольной теплоёмкости? 16. Покажите на примере зависимость теплоёмкости газа от особенностей термодинамического процесса? 17. Используя I закон термодинамики представьте вывод уравнения Майера для массовой и мольной теплоёмкости. 18. Почему мольная теплоёмкость газа μcp, μcv изменяется с увеличением атомности газа? Какова их величина? 19. Почему разность мольных теплоемкостей μcp, μcv для всех газов и смесей величина постоянная, а разность массовых теплоемкостей cp - cv зависит от рода газа? 20. В каких пределах может измениться величина теплоёмкости газа и какой фактор наиболее существенно на неё влияет? 21. Рассчитать теплоёмкости cр, cv, 22. Определите теплоёмкости ср и сv для воздуха при t = 200 °С и t = 1200 °C. 23. Как определяется ср см, cv см, Rсм “k”| для газовой смеси. 24. В чем преимущества квантовой теории теплоёмкости? Как в соответствии с этой теорией определить μcp, μcv, μR.
СОДЕРЖАНИЕ
|



 .
. Дж/(кг · К);
Дж/(кг · К); .
. кДж/(м3 · К),
кДж/(м3 · К), .
. .
. ,
,  , cрт, cvт,
, cрт, cvт,  ,
, 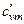 , μcp, μcv. Указать связь между ними.
, μcp, μcv. Указать связь между ними.