 ПОЗНАВАТЕЛЬНОЕ
| Корозія металів та методи захисту від корозії 12
Корозія – це руйнування матеріалів під дією навколишнього середовища. Якщо вироб складається з різних матеріалів, то при наявності електричного контакту між ними він, будучи зануреним в розчинник, стає подібним до гальванічного елементу. Метал, який має більш негативний електродний потенціал, розчиняється, ніби він є катодом гальванічного елементу. Якщо залізо, яке контактує з міддю занурено в звичайну воду, то на поверхні заліза відбувається процес окислення: Fe(тв) -2е → Fe2+(р) який продовжується в розчині і закінчується утворенням ферум (Ш) оксиду (іржа). 4Fe2+(р)+О2+4Н2О → 2Fe2О3(тв)+8Н+(р) Потенціал міді при цьому підвищується і призводить до електростатичного притяжіння катіонів Н+ із розчину до іі поверхні, де вони відновлюються, утворюючи газоподібний водень: 2Н+(р)+2е→Н2(г) В інших випадках можливе відновлення на поверхні електронегативного металу розчиненого у воді кисню з утворенням води: 4Н+(р) +О2+4е→2Н2О Таким чином, на поверхні міді і заліза відбуваються окисно-відновні процеси, подібні процесам, які відбуваються на електродах гальванічного елементу. Електрохімічна корозія руйнує не тільки сплави та поліметалічні вироби, але й чисті метали. По-перше, мікроструктура навіть однорідного за хімічним складом виробу неоднорідна за фізичним складом: поряд з правильними кристалами в його складі є кристали з порушеною будовою. Це може призвести до утворення на поверхні такого виробу великої кількості мікроскопічних гальванічних елементів. Тому ковані вироби або вироби, які піддаються деформації нерівномірною механічною дією (ударом), більш піддаються корозії, ніж вироби, виготовлені литтям. По-друге, поверхня виробу звичайно має мікроскопічні дефекти: тріщини, зазори, тощо. Це є причиною корозії. Загальне в електрохімічній корозії те, що в усіх випадках на поверхні металевого виробу утворюється гальванічна пара. На швидкість корозії впливає: рН-середовища, температура, рух рідини, склад і структура металу, деформація, обробка поверхні. Для попередження корозії існує багато засобів. Найбільш ефективні і прості з них - це ізоляція виробу від навколишнього середовища, шляхом покриття його поверхні корозійностійкими матеріалами: лаками, фарбами, оксидними плівками тощо. Але в ряді випадків такий захист неефективний – швидко руйнується. Тоді використовують протекторний захист. В основі протекторного захисту полягає спеціально створена гальванічна пара з катодом, електродний потенціал якого негативніше електродного потенціалу самого хімічно активного компоненту сплаву, з якого виготовлено вироб. Анодом в такій гальванічній парі виступає вироб, точніше – самий пасивний компонент сплаву. При взаємному доторканні такої гальванічної пари з розчинником кородиювати буде лише матеріал протектора, забезпечуючи тим самим збереженість виробу. Акумулятори Акумулятором називається гальванічна система, яка здатна накопичувати під дією електричного струму хімічну енергію і при необхідності віддавати її у вигляді електричної енергії. При розрядці в акумуляторах енергія хімічних реакцій перетворюється в електричну. Навпаки, при зарядці електрична енергія переходе в потенціальну хімічну енергію. Акумулятори розрізняють за хімічною природою речовини електродів і електролітів, конструкцією електродів, величинами ЕРС тощо. Частіше застосовують свинцеві (кислотні), кадмієво – нікелеві, залізо – нікелеві (лужні) акумулятори. В свинцевому акумуляторі електродами є дві свинцеві пластини, які покриті плюмбум оксидом і занурені в 30% Н2SО4. Для створення різниці електродних потенціалів проводять зарядку акумуляторів:
При розрядці акумуляторів реакції відбуваються в зворотному напрямку. Процеси в акумуляторах оборотні зарядка
розрядка Для свинцевих акумуляторів Е=2,02В.
Паливний елемент Паливним елементом називається гальванічний елемент, в якому електрохімічно активними речовинами є традиційне паливо та кисень Паливний елемент має високий ККД 50-70% і більше.
Електроди паливного елемента виготовлені порожніми із пористого спресованого вугілля, просоченого каталізатором. В порожнину катоду надходить горючий матеріал – паливо. В порожнину аноду надходить кисень або повітря. Електролітом служить 30-40% водневий розчин КОН. Під час роботи елементу паливо (водень) проходе крізь пори катоду на його зовнішню поверхню, де окиснюється: 2Н2(г)+4ОН-(р) Одночасно кисень проходе крізь пори аноду на його зовнішню поверхню, де відновлюється: О2(г)+ 2Н2О(р) Сумарна реакція має вигляд: 2Н2(г)+ О2(г) → 2Н2О(р) Якщо в паливному елементі використовують не водень, а іншу горючу речовину, то реакції на електродах будуть іншими. Паливний елемент компактніше гальванічних елементів, тому їх успішно використовують на космічних кораблях, підводних човнах тощо. Широке використання паливних елементів поки що стримується високою вартістю їх виготовлення і необхідністю спеціально підготовленого палива. Вони можуть бути використані не тільки в якості джерел живлення радіоапаратури і електронних приладів, але і на транспорті. 12 |




 на катоді
на катоді 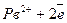


 на аноді
на аноді 





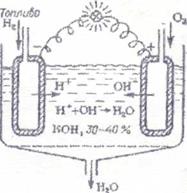 Принципова схема паливного елементу.
Принципова схема паливного елементу. 4Н2О(р)
4Н2О(р) 4ОН-(р)
4ОН-(р)