 ПОЗНАВАТЕЛЬНОЕ
| Властивості та застосування берилію, магнію, лужноземельних металів та їх сполук 12
Берилій, магній та лужноземельні метали мають сріблясто-білий колір, легкі (за виключенням радію), хоча густина їх значно вища, ніж у лужних металів. Найбільш міцну кристалічну ґратку має берилій, оскільки його іони і атоми мають найменші розміри. Тому берилій за твердістю, температурам плавлення і кипіння значно перевершує інші метали, які утворюються елементами даної групи. Полум’я зафарбовується летючими сполуками кальцію в помаранчево-червоний колір, сполуками стронцію і радію – в кармінно-червоний і сполуками барію – в жовто-зелений. В хімічному відношенні дані метали характеризуються значною активністю. Всі вони окислюються киснем повітря. Оксидна плівка, яка утворюється на поверхні берилію, захищає його від подальших змін; захисні властивості оксидної плівки магнію і особливо лужноземельних металів значно слабкіші. Дані метали взаємодіють з іншими неметалами: хлором, сіркою, азотом, а також з водою, витискуючи водень: Ме + 2Н2О = Ме(ОН)2 + Н2↑. Але є суттєві відмінності в активності цих металів по відношенню до неметалів, води і кислот. Так, берилій спалахує на повітрі тільки при сильному нагріванні, магній і кальцій – при меншому нагріванні, а стронцій і барій легко спалахують. Завдяки міцній оксидній плівці на берилій вода майже не діє. Магній розкладає воду дуже повільно внаслідок утворення погано розчинного магній гідроксиду, при нагріванні реакція посилюється. Лужноземельні метали взаємодіють з водою за звичайних умов, утворюючи луги і водень. Із збільшенням іонних радіусів Ме2+ в ряду Ве – Ва швидко збільшується розчинність гідроксидів Ме(ОН)2 і посилюється їх основний характер. Із гідроксидів цих металів тільки аморфний Ве(ОН)2, подібно до Al(ОН)3, має амфотерні властивості і розчиняється як в кислотах, так і в лугах (в концентрованих H2SO4 і НNО3, як і алюміній, пасивується): Ве(ОН)2 + 2КОН = К2[Be(OH)4]; Ве(ОН)2 + 2HCl = ВеCl2 + 2H2O. Метали даної підгрупи, їх оксиди і гідроксиди утворюють з кислотами відповідні солі: Mg + H2SO4 = MgSO4 + H2↑; ВаО + 2HCl = ВаCl2 + H2O; Sr(OH)2 + 2HNO3 = Sr(NO3)2 + 2H2O. Сульфати, карбонати і фосфати цих металів в воді розчиняються погано, а хлориди, броміди, йодиди – добре. Сульфіди малорозчинні у воді і добре гідролізують. Гідрокарбонати відомі тільки в водних розчинах і утворюються із карбонатів: МеСО3 + H2O + СО2 = Ме(НСО3)2. При нагріванні розчинів гідрокарбонатів відбувається їх розклад з осадженням карбонатів: Ме(НСО3)2 = МеСО3↓ + СО2↑ + H2O. Висока хімічна активність s-елементів І та ІІ груп ПС виключає можливість їх знаходження в природі в вільному стані. Найбільш розповсюджені в вигляді сполук Са (3,63% мас.) та Mg (2,09% мас.). Мінерали, до складу яких входять елементи даної підгрупи: кальцит, арагоніт СаСО3, тальк Mg3[Si4O10](OH)2, магнезіт MgСО3, доломіт MgСО3∙СаСО3, флюорит СаF2, гіпс СаSO4∙2Н2О, берил Ве3Al2[Si6O18], целестин SrSO4, стронціаніт SrСО3, барит ВаSO4, вітерит ВаСО3 та інші. Іони Mg2+ містяться в морській воді, надаючи їй гіркий смак. Радій в дуже невеликих кількостях міститься в уранових рудах. Сполуки берилію отруйні. Берилій використовують для легування сплавів; додаток його надає сплавам підвищену корозійну стійкість, високу міцність і твердість. Найбільш цінними є сплави міді з берилієм (берилієві бронзи), які містять до 2,5% Ве. Ці сплави використовують в літакобудуванні, електротехніці. У магнію металічні властивості виражені сильніше, ніж у берилію. Він більш схильний до утворення іонних зв’язків, іон Мg2+ стійкий і в розчинах, і в кристалах солей. Магній більш м’який і пластичний, ніж берилій. Магній використовується для виробництва надлегких сплавів. Найбільш важливий сплав магнію – «електрон» (3-10% Al, 0,2 – 3% Zn, решта - Mg) завдяки міцності і малій густині (1,8 г/см3) широко застосовується в літакобудуванні і ракетній техніці. Металічні Са, Sr, Ва і Ra застосовуються не так широко, як Мg. Кальцій застосовується для утворення сплавів, наприклад, сплави свинцю з кальцієм використовують в акумуляторах. Стронцій використовують в виплавці бронз для їх очистки від шкідливих домішок та в електровакуумній техніці. Кальцій і його сполуки Кальцій – сріблясто-білий метал, який плавиться при температурі 8500С. Він значно міцніший і твердіший, ніж лужні метали, але також активний метал. Так, за звичайних умов він реагує з киснем повітря, водою, галогенами: 2Са + О2 = 2СаО; 2СаО + 2H2O = Са(ОН)2 + Н2; Са + Cl2 = СаCl2. З іншими неметалами і воднем взаємодіє при нагріванні: 3Са + N2 = Ca3N2; Ca + S = CaS; 3Ca + 2P = Ca3P2; Ca + H2 = CaH2. Кальцій здатен віднімати кисень або галогени від оксидів або галогенідів менш активних металів: 2Са + ТіО2 = 2СаО + Ті; 2Са + ТіCl 4 = 2СаCl2 + Ті. Із сполук кальцію, які найбільш широко використовуються, варто виділити СаСО3, СаSО4, Са3(РО4)2 і СаCl2. Кальцій карбонат СаСО3 – головна складова частина вапняку, крейди, мармуру. Із вапняку виготовляють вапно (негашене, гашене і хлорне). В значних кількостях вапняк використовується в металургії як флюс. Кальцій карбонат, який входить до складу природних гірських порід, під дією води та карбон (ІV) оксиду частково переходить в розчин у вигляді кальцій гідрогенкарбонату СаСО3 + СО2 + Н2О = Са(НСО3)2 і переноситься підземними та річними водами на великі відстані. Природна вода, яка містить в розчині значну кількість іонів Са2+ і Мg2+ у вигляді солей Са (або Мg), називається твердою. Тверда вода утворює в парових котлах та котельних установках шар накипу за реакцією: Са(НСО3)2 = СаСО3↓ + СО2↑ + Н2О. Накип погано проводить електричний струм, викликає збільшення витрат пального і прискорює винашування парових котлів і котельних установок. Для узагальнення знань з властивостей розглянутих s-елементів І та ІІ груп ПС та їх сполук складемо таблицю. Таблиця 12.3 Узагальнення властивостей s-елементів І та ІІ груп ПС
Проаналізуйте дану таблицю. Поясніть зміну властивостей хімічних елементів Ве, Мg, Са, Sr, Ва та їх сполук за положенням в періодичній системі Д.І. Менделєєва. 2. Запитання для самоконтролю і контролю знань 1. В чому полягають особливості будови атомів s-елементів? 2. Які ступені окиснення в сполуках проявляють s -елементи І та ІІ груп ПС? Чому? 3. У вигляді яких мінералів Ве, Mg, Са, Ва, Ra знаходяться в природі? 4. Порівняйте фізичні властивості даних металів. 5. Складіть рівняння хімічних реакцій, які підтверджують хімічні властивості берилію, магнію, кальцію, барію. 6. Поясніть характер оксидів, пероксидів та гідроксидів даних металів. Доведіть це за допомогою рівнянь хімічних реакцій. 7. Поясніть окисно-відновні властивості сполук даних металів. Доведіть це за допомогою рівнянь хімічних реакцій. 8. Як хімічним способом довести наявність амфотерних властивостей сполук берилію? 9. Як застосовуються дані метали та їх сполуки в промисловості? Які сплави з них виготовляють? 3. Приклади розв’язання задач для самостійної роботи 1. Лужноземельний метал масою 10 г окислили хлором. При цьому одержали 27,75 г його хлориду. Визначте метал. Лужноземельні метали в сполуках проявляють ступінь окиснення +2. Якщо метал позначимо Ме, то формула хлориду буде МеCl2. Молярну масу металу позначимо х г/моль. Тоді молярна маса металу (х+71) г/моль. Реакція відбувається за рівнянням: 10г 27,75г Ме + Cl2 = МеCl2 хг (х+71)г Складаємо алгебраїчне рівняння: 10(х + 71) = 27,75х; х = 40. Це лужноземельний метал кальцій. 2. Маса твердого залишку, утвореного після прожарювання до постійної маси суміші кальцій гідроксиду та кальцій карбонату, зменшилась на 40% порівняно з масою вихідної суміші. Обчисліть масові частки (%) речовин у вихідній суміші. Припустимо, що маємо 100 г суміші, яка містить х г Са(ОН)2 та (100 – х)г СаСО3. Маса суміші після прожарювання зменшилась на 40%, тобто на 40 г тому, що обидві речовини розкладуться з виділенням газоподібних речовин Н2О і СО2. За рівняннями реакцій розрахуємо маси водяних парів та вуглекислого газу, які виділяться під час термолізу суміші: х г а г Са(ОН)2 = СаО + Н2О; 74 г 18 г
(100 – х)г b г СаСО3 = СаО + СО2; 100 г 44 г
Звідси х = 20,32 г.
Розрахуємо масові частки Са(ОН)2 та СаСО3 в 100 г суміші: ω(%) (Са(ОН)2) = ω(%) (СаСО3) = 100 – 20,32 = 79,68%. 3. Розчин магній нітрату об’ємом 500 мл містить 1,6 моль солі, ступінь дисоціації якої 90%. Розрахуйте маси катіонів та нітрат-аніонів, що містяться в 1,5 л такого ж розчину. Якщо в 500 мл розчину магній нітрату міститься 1,6 моль солі, то в 1,5 л його: Виходячи з того, що ступінь дисоціації визначається: α = ν(Mg2+) = 0,9 ∙ 4,8 = 4,32 моль; тоді m(Mg2+) = 4,32 ∙ 24 = 103,68 г;
Завдання для самоконтролю Рівень А 1. Окисненням лужного металу масою 70 г одержали 150 г його оксиду. Визначте метал. 2. Визначте масу калію, яку необхідно використати для приготування 200 г розчину калій гідроксиду з масовою часткою лугу 10%. 3. У воді об’ємом 0,5 л розчинили 0,75 моль калію. Який об’єм (н.у.) водню при цьому виділився? Рівень В 1. Лужноземельний метал масою 25 г окислили киснем повітря. Добутий оксид розчинили у воді. Утворилось 46,25 г гідроксиду. Який метал використали? 2. При термічному розкладі суміші магній оксиду та магній карбонату масою 58,4 г одержали 32 г твердого залишку. Обчисліть масову частку (%) магній оксиду у вихідній суміші. 3. Приготували 800 мл розчину кальцій хлориду, що містить 2,5 моль солі, ступінь дисоціації якої дорівнює 85%. Визначте маси катіонів кальцію та аніонів хлору в 400 мл цього розчину. Рівень С 1. При електролізі розплаву 4 г бінарної речовини на аноді виділилось 1,12 л водню (н.у.). Визначте формулу речовини. Чи можна провести електроліз водного розчину цієї речовини? 2. Сплав натрію та калію масою 0,15 г розчинили у воді. При цьому одержали 300 мл розчину із вмістом гідроксид-іонів 1,82∙10-2 моль/л. Визначте масові частки металів (%) у вихідному сплаві. 3. Суміш натрій гідроксиду та натрій гідрогенкарбонату масою 66,4 г прожарили при температурі 2600С. Маса одержаної суміші виявилась на 13,4 г меншою від маси вихідної суміші. Розрахуйте масові частки (%) речовин у вихідній суміші. Експериментальна частина Дослід 1Добування сполук натрію. Рівень А Добування натрій карбонату. В дві сухі пробірки внесіть по кілька кристаликів натрій гідрогенкарбонату NаНСО3. В одній з пробірок кристалики злегка прожарте на вогні і дайте пробірці охолонути. У кожну пробірку налийте по 2 мл води, додайте по одній краплі фенолфталеїну і спостерігайте відмінність забарвлення розчинів у пробірках. Яке середовище розчинів (лужне, нейтральне, кисле)? Реакція відбувається за рівнянням: 2NаНСО3 = Nа2СО3 + СО2↑ + Н2О. Поясніть дослід. Запишіть спостереження, зробіть висновки. Рівень В Добування натрій гідроген карбонату. У пробірку внесіть 0,8 г натрій карбонату, додайте 5 мл води, розчиніть натрій карбонат при перемішуванні. Дослідіть реакцію розчину лакмусом, фенолфталеїном і метиловим оранжевим. Для цього нанесіть на фільтрувальний папір по краплі індикаторів і торкніться послідовно цих місць кінцем скляної палички, змоченої досліджуваним розчином. Через газовідвідну трубку повільно пропускайте вуглекислий газ із апарата Кіппа, доки розчин не перестане забарвлювати фенолфталеїн. Утворений в пробірці осад відфільтруйте, промийте невеликою кількістю води і висушіть між листами фільтрувального паперу. Невелику кількість висушеної речовини розчиніть дистильованою водою і дослідіть індикаторами. Якої величини рН в утвореному розчині (див. ЛР 2, табл. 2.3.)? Запишіть спостереження, зробіть висновки. Рівень В Добування їдкого натру з кальцинованої соди. У хімічний стакан налийте 50 мл води, додайте 2 г кальцинованої соди і 5 г гашеного вапна. Суміш нагрійте до кипіння і повільно кип’ятіть протягом 10 хвилин при безперервному перемішуванні скляною паличкою. Після охолодження відфільтруйте 2-3 мл розчину в пробірку і фільтрат підкисліть розбавленим розчином сульфатної кислоти. Припинення виділення з фільтрату бульбашок газу та утворення осаду засвідчує закінчення реакції. Запишіть рівняння проведених хімічних реакцій, поясніть доцільність їх проведення. Запишіть спостереження, зробіть висновки. Запропонуйте інші способи утворення їдкого натру. Дослід 2Дослідження хімічних властивостей натрію, магнію, кальцію. Рівень А Взаємодія натрію, кальцію з водою. Досліди необхідно проводити в витяжній шафі. В три пробірки налийте по 2-3 мл дистильованої води, додайте по одній краплі фенолфталеїну. В кожну з пробірок покладіть по шматочку натрію, кальцію, висушених фільтрувальним папером. Спостерігайте особливості проходження хімічної реакції для кожного з металів, порівняйте їх. Як забарвився фенолфталеїн? Чому? Поясніть різницю в проходженні хімічних реакцій, використовуючи ПС і ряд стандартних електродних потенціалів металів. Складіть рівняння хімічних реакцій. Запишіть спостереження, зробіть висновки. Рівень В Взаємодія магнію з водою. В пробірку внесіть 2-3 мл дистильованої води і опустіть в неї шматочок магнієвої стрічки. Спостерігайте, чи проходить хімічна реакція. Після цього поверхню магнієвою стрічки очистіть наждачним папером і знов опустіть у пробірку з водою, спостерігаючи, чи проходить хімічна реакція. Нагрійте пробірку в полум’ї пальника. Додайте до розчину одну краплю фенолфталеїну. На утворення яких іонів вказує забарвлення фенолфталеїну? Поясніть всі процеси, які спостерігали. Складіть рівняння хімічних реакцій. Запишіть спостереження, зробіть висновки. Рівень С Взаємодія магнію з кислотами. Доведіть теоретично, як магній взаємодіє з хлоридною, розбавленою сульфатною, концентрованою сульфатною кислотами, нітратною кислотою різної концентрації. Поясніть різницю в проходженні хімічних реакцій. Експериментально перевірте гіпотезу. Досліди необхідно проводити в витяжній шафі. Складіть рівняння хімічних реакцій. Проаналізуйте і запишіть спостереження. Зробіть висновки. Дослід 3Дослідження хімічних властивостей солей кальцію. Рівень А Термічне розкладання кальцій карбонату. Шматочок мармуру візьміть тигельними щипцями і прожарте кілька хвилин у зовнішній зоні полум’я пальника. Після охолодження покладіть мармур у фарфорову чашку, додайте декілька крапель води і краплю фенолфталеїну. Спостерігайте тепловий ефект при додаванні води і забарвлення фенолфталеїну. Поясніть хімічні процеси, які спостерігали. Складіть рівняння хімічних реакцій. Дайте назви речовинам. Запишіть спостереження, зробіть висновки. Рівень В Перехід кальцій карбонату в кальцій гідрокарбонат і навпаки. У пробірку насипте 1 мікрошпатель порошку крейди, долийте 4-5 мл води й упродовж декілька хвилин пропускайте з апарата Кіппа вуглекислий газ до розчинення муті. Якщо муть залишилась, розчин відфільтруйте у пробірку і фільтрат нагрійте до кипіння. Осад, що утворився, розчиніть водою і знову пропустіть крізь нього вуглекислий газ. Поясніть хімічні реакції, які ви провели. Складіть рівняння хімічних реакцій. Запишіть спостереження, зробіть висновки. Наведіть приклади аналогічних хімічних реакцій, які відбуваються в природі. Рівень С Дослідження розчинності солей кальцію. Проаналізуйте розчинність солей кальцію, використавши таблицю розчинності солей. Експериментально перевірте це за дапомогою запропонованих дослідів. У пробірку насипте 1 мікрошпатель кальцій хлориду. Долийте 3-4 мл води. Спостерігайте рівень розчинності солі у воді. До розчину, що утворився, додайте розчин амоній сульфату. Порівняйте розчин утвореної солі з першим розчином. В другу пробірку насипте 1 мікрошпатель порошку гіпсу, долийте 4-5 мл води, інтенсивно збовтайте, спостерігаючи розчинність солі у воді. Розчин відфільтруйте, до фільтрату додайте розчин амоній карбонату. Констатуйте рівень розчинності утвореної солі. Складіть рівняння хімічних реакцій. Запишіть спостереження, зробіть висновки. 12 |



 - s1
- s1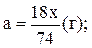





 ,
,