 ПОЗНАВАТЕЛЬНОЕ
| Реакции гетерогенного гидрирования
Каталитическое гидрирование в лаборатории проводят перемешиванием или встряхиванием раствора восстанавливаемого вещества в присутствии гетерогенного катализатора в атмосфере водорода. Степень прохождения гидрирования проверяют по поглощению водорода: при проведении реакции в автоклаве при повышенном давлении – по изменению давления, при гидрировании при атмосферном давлении - по изменению высоты столба водорода в газовой бюретке. Удобство метода каталитического гидрирования состоит в простоте выделения продукта - раствор отфильтровывают от катализатора, а затем отгоняют растворитель. Выбор растворителя зависит от типа используемого катализатора и температуры реакции. По условиям реакции гидрирования катализаторы можно разделить на два типа.
К типу 1 относятся благородные металлы (Pt, Pd, Rh) и никель Ренея. Они требуют относительно низких температур (0-100°) и давления (1-4 атм). Тип 2 включает менее активные катализаторы, например CuCr2O4, никель Ренея. Они активны только при использовании высокого давления (100-300 атм) и температуры 25-300°.
Надо заметить, что никель Ренея используется для гидрирования как при низком, так и при высоком давлении водорода. Палладий и родий обычно применяют в виде металла, нанесенного на инертную подложку (уголь, BaSO4, Al2O3, CaCO3, SrCO3). Понятие «инертная подложка» весьма относительно, поскольку активность катализатора зависит от природы подложки:
M/C
M = металл
Скорость гидрирования зависит также от природы растворителя. В протонных растворителях гидрирование многих функциональных групп идет быстрее, чем в нейтральных неполярных растворителях. Ниже приведены растворители, обычно используемые для гидрирования при низком давлении. Они расположены в порядке увеличения легкости гидрирования:
CH3COOEt < C2H5OH < H2O < CH3COOH < CH3COOH + HClO4
Конечно, растворители, проявляющие кислотные свойства, нельзя использовать, если катализатор нанесен на карбонат. Приведем примеры реакций гидрирования при низком давлении:
Как видно из приведенных примеров, ни карбоксильная, ни сложноэфирная группа в этих условиях не восстанавливаются. Карбонильная группа легко восстанавливается при проведении реакции в протонном растворителе, где быстро устанавливается кето-енольное равновесие, но обычно устойчива к гидрированию в апротонных растворителях. Относительная легкость гидрирования различных функциональных групп приведена в таблице 1, где легкость восстановления уменьшается сверху вниз. Это означает, что функциональные группы, расположенные выше, обычно можно гидрировать в присутствии функциональных групп, находящихся в таблице ниже, без восстановления последних. Например, можно прогидрировать связь C=C, не затрагивая группу C=O.
Можно также гидрировать карбонильную группу в присутствии карбоксильной:
Таблица 1 - Реакционная способность функциональных групп в реакциях каталитического гидрирования
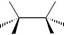
Нанесенные катализаторы можно приготовить реакцией соли соответствующего металла с борогидридом натрия в присутствии носителя, например:
C2H5OH, 25о
Источником водорода для гидрирования в данном случае является NaBH4, при добавлении которого к кислоте образуется H2.
При таком подходе отпадает необходимость в баллоне с водородом или другом источнике водорода. Однако этот подход не лишен недостатков, главными из которых являются: 1) необходимость отделять продукт гидрирования от других растворенных веществ; 2) возможность восстановления других функциональных групп в молекуле при действии NaBH4. Своеобразными катализаторами гидрирования являются черные коллоидные растворы «боридов никеля», так называемые P-1-Ni и P-2-Ni.
Катализатор P-2-Ni менее активен и более селективен, чем P-1-Ni. Так с помощью этого катализатора можно селективно гидрировать более напряженную C=C связь в присутствии менее напряженной:
Борид никеля весьма селективен по отношению к алкенам разного типа. Ниже приведено время полугидрирования алкенов в присутствии P-2-Ni (в минутах):
Катализаторы типа 2 используют для гидрирования при высоком давлении водорода (100-300 атм). В первую очередь это никель Ренея, хромит меди (катализатор Лэзира), рутений на угле и на Al2O3. В зависимости от свойств вещества, которое надо восстановить, гидрирование при высокой температуре и давлении можно проводить как в растворе, так и в отсутствие растворителя. Процесс проводят в специально оборудованном автоклаве. Обычно при этом используют следующие растворители: этиловый спирт, воду, циклогексан, метилциклогексан. Ниже приведены примеры подобных реакций.
Скорость гидрирования можно увеличить тремя путями:
1) увеличением давления;
2) увеличением количества катализатора;
3) увеличением температуры.
При возможности выбора для ускорения реакции лучше использовать повышение давления, а не температуры, так как повышение температуры может привести к изменению направления реакции, например, к гидрированию ароматического кольца, если таковое имеется. Если соединение гидрируется как при высоком, так и при низком давлении водорода, выбор давления зависит от количества вещества:
1) 10 мг ÷ 100 г − низкое давление
2) 10 г ÷ 1000 г − высокое давление.
Различные металлы проявляют разную каталитическую активность при гидрировании одного и того же соединения. Ниже приведен ряд относительной каталитической активности металлов при гидрировании пропена:
Rh > Ir > Ru > Pt > Pd > Ni > Fe > Co > Os
Наиболее активным является родиевый катализатор. Любопытно, что каталитическая активность в данном случае не коррелирует с энергиями активации соответствующих реакций. В таблице 2 приведены катализаторы, наиболее часто используемые для гидрирования тех или иных органических соединений. В таблице 2 указано рекомендуемое количество катализатора в мольных процентах, т.е. в числе молей катализатора на 100 молей субстрата.
Каталитическое гидрирование − реакция хемоселективная. Так, например, в соединении (3) можно, варьируя катализатор, избирательно гидрировать ту или иную связь C=C, не затрагивая карбонильные группы.
Таблица 2 - Рекомендуемые условия проведения реакций каталитического гидрирования некоторых классов органических соединений**
** A = 5% Pd/C; B = PtO2; C = никель Ренея; D = 0,3% Pd/CaCO3; E = 5% Pd/BaSO4; F = катализатор Линдлара; G = 5% Rh/Al2O3; H = 5%Rh/C
Более замещенные алкены плохо адсорбируются на поверхности катализатора и поэтому восстанавливаются труднее менее замещенных алкенов. Ниже приведена относительная легкость гидрирования алкенов в зависимости от степени их замещения:
Если в молекуле имеется напряженная двойная связь, то в первую очередь гидрируется именно она. Примером может служить гидрирование дициклопентадиена на катализаторе P-2-Ni (см. стр. 33). На практике часто бывает сложно предсказать хемоселективность гидрирования. Решающее слово остается за экспериментом.
Каталитическое гидрирование − стереоселективная реакция. Обычно она происходит как син-присоединение.
рацемат
В циклических молекулах при гидрировании преимущественно атакуется стерически менее затрудненная сторона.
Син-гидрирование происходит в тех случаях,когда молекула водорода и алкеновый фрагментсубстрата связываются с поверхностью катализатора так, что подход обоих атомов водорода к молекуле субстрата осуществляется одновременно с одной ее стороны. Если при этом алкен связывается с катализатором достаточно прочно, то продуктом реакции является один стереоизомер (цис). Однако при менее прочном связывании алкена с поверхностью катализатора присоединение водорода происходит ступенчато. После присоединения первого атома водорода может произойти как изменение положения молекулы субстрата на поверхности катализатора, так и различные процессы изомеризации. В этом случае преимущественным направлением реакции может оказаться анти-присоединение,например:
Способность катализаторов образовывать при гидрировании продукт цис-присоединения изменяется в ряду:
Ir > Os > Rh, Ru, Pt >> Pd
Действительно, платиновые катализаторы дают в основном цис-продукт (кинетический контроль реакции), а при использовании палладиевого катализатора часто образуется продукт анти-присоединения (термодинамический контроль реакции).
Таким образом, предсказание стереохимии гидрирования во многих случаях является непростой задачей. Стереохимия может изменяться в зависимости от используемого катализатора, условий реакции и даже чистоты вводимого в реакцию алкена. Другой фактор, влияющий на стереохимию гидрирования – так называемая гаптофильность. О гаптофильности говорят в тех случаях, когда молекула субстрата содержит функциональную группу, обладающую выраженной способностью связываться с катализатором. Следствием такого связывания является присоединение водорода с той же стороны молекулы, на которой расположена гаптофильная группа.
H2, Pd/C, 1 атм
катализатор
Рис. 1. Зависимость характера адсорбции субстрата при наличии объемной группы (R) или гаптофила (R′).
a) − Затруднение адсорбции, вызванное объемной группой R
b) − Расположение молекулы субстрата, при котором группа R не препятствует адсорбции
c) – Адсорбция молекулы со стороны гаптофила R′
12 |



 M/BaSO4
M/BaSO4 














 Na2PtCl6 NaBH4, C-порошок Pt/C
Na2PtCl6 NaBH4, C-порошок Pt/C















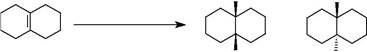
 MeO
MeO Стереохимические факторы, влияющие на процесс гидрирования, резюмированы на рис.1.
Стереохимические факторы, влияющие на процесс гидрирования, резюмированы на рис.1.