 ПОЗНАВАТЕЛЬНОЕ
| обмін, окиснення, біосинтез.
Перетравлювання, емульгуванння, міцелоутворення, жовчні кислоти, панкреатичний сік, гідроліз, гліцерин, жирні кислоти, всмоктування, хіломікрони, а- і fi-ліпопротеїни, обмін, окиснення, біосинтез. 1. ФУНКЦІЇ ЛІПІДІВ В ОРГАНІЗМІ
► До ліпідів належать жири (жир - від грецьк. lipos) та жироподібні речовини. Вони об'єднують велику групу різних за хімічною природою речовин, які мають деякі спільні ознаки: гідрофобність, наявність алкільних радикалів або карбоциклів, біогенність, фізико-хімічні властивості (наприклад, ліпіди нерозчинні у воді, а розчинні в органічних розчинниках - бензині, хлороформі тощо).
—►Пластична ► Пластичний матеріал структурних елементів клітин, містяться у мембранах та в органелах клітин. —► Субстратна * Субстрат для утворення біологічно активних речовин (вітамінів А, Д, гормонів, жовчних кислот та ін. ). Беруть участь у численних метаболічних процесах. —► Регуляторна ► Нормалізують водний обмін (в екстремальних умовах є джерелом води), впливають на стан нервової системи, функції сальних залоз. Деякі ліпіди є попередниками вітамінів, гормонів, в тому числі гормонів місцевої дії - ейкозаноїдів: простагландинів, тромбоксанів, лейкотриєнів. Порушення ліпідного обміну у людини призводить до патологій - атеросклерозу, жовчнокам’яної хвороби, ожиріння тощо. —► Ліпотропна ► Беруть участь у процесах метаболізму в організмі —► Механічна ► Приймають участь у динамічних процесах Запасна ► Накопичуються у значній кількості у
(резервна) протоплазмі. Депонуються як метаболічне паливо - найбільш компактна форма депонування енергії. Вміст жиру в організмі дорослої людини 6 - 10 кг. Резервуються в адіпоцитах - клітинах жирової тканини.
► В окрему групу виділяють речовини, які розчиняються в органічних розчинниках, але на відміну від простих та складних ліпідів не омилюються. До цієї групи належать вільні карбонові (жирні) кислоти, окремі жиророзчинні вітаміни, каротин тощо. Класифікація вищих жирних кислот (ВЖЮ В природі відомо більше, ніж 200 високомолекулярних жирних кислот, які класифікують на декілька груп.
Номенклатура ВЖК. to-З та ю-6 кислоти У ВЖК атоми С нумерують від групи СООН:
Положення подвійного зв’язку у ненасичених ВЖК може бути позначене шляхом нумерації з со-вуглеродного атома (- СНз), як першого.

3.
ХІМІЧНА ПРИРОДА ПРОСТИХ ТА СКЛАДНИХ ЛІПІДІВ
--------------------------- 1 Складні ліпіди -►Фосфоліпіди ► До складу молекул фосфоліпідів входять залишки багатоатомного спирту гліцерину (фосфатиди) або сфінгозину (фосфосфінгозиди), вищих карбонових кислот, фосфорної кислоти, азотистих основ — (часто холіну, коламіну (етаноламіну), серину)
лецитин ^ Гліколі піди ► Молекули нейтральних гліколіпідів побудовані з ковалентно зв’язаних ліпідного та вуглеводного компонентів. Це моно- і дигалактозилгліцероли, які містять R-залишки жирних кислот. З вуглеводів, крім галактози, може входити глюкоза.
4.
ПЕРЕТВОРЕННЯ ЛІПІДІВ У ШЛУНКОВО- КИШКОВОМУ ТРАКТІ
!! Продукти розщеплення ліпідів всмоктуються в стінках кишок (приблизно 40 % всмоктується у вигляді гліцеролу й ВЖК, 3-8 % - у вигляді ди- і тригліцеролів і ~ 40 % - у вигляді моноацилгліцеролів). Всмоктування відбувається за участю солей жовчних кислот, фосфоліпідів і холестеролу, які містяться в жовчі. Із них в епітеліальних клітинах синтезуються (ресинтезуються) ліпіди, специфічні для даного організму. ► Ресинтезовані ліпіди, які всмокталися з порожнини кишок, і деякі продукти розщеплення жирів (жирні кислоти), які не були використані в ресинтезі, здатні з’єднуватися з білками крові і утворювати транспортні форми ліпідів.

5. ВНУТРІШНЬОКЛІТИННИЙ ОБМІН ЛІПІДІВ ► На цьому етапі відбуваються катаболічні й анаболічні реакції, які забезпечують як асиміляцію ліпідів у виді пластичного матеріалу, так і окйснення їх до кінцевих продуктів. Під час окиснення ліпідів вивільняється значна кількість енергії, яка нагромаджується в макроергічних зв'язках. Внутрішньоклітинний обмін тригліцеридів
Енергетика окиснення жирних кислот ► При розрахунку балансу АТФ вважають, що всі утворені молекули ацетил-КоА включаються до циклу Кребса і їх повне окиснення супроводжується синтезом 12 молекул АТФ в розрахунку на окиснення 1 молекули ацетилу. !! При здійсненні одного циклу окиснення молекули жирної кислоти витрачається 1 молекула АТФ та утворюється 1 молекула НАД-Н + Н+ та одна молекула ФАД-Н2 З І молекули НАД-Н + Н+ утворюється 3 молекули АТФ, азі молекули ФАД-Н2 - 2 молекули АТФ. Таким чином в одному циклі р-окиснення синтезується 5 АТФ. Формула для окиснення жирної кислоти, що складається з n-атомів вуглецю:
Тобто, при окисленні 1 молекули пальмітинової кислоти (Сіб) баланс АТФ складає 130 молекул: [5АТФ • 7 + 12АТФ • 8] - 1АТФ = 130АТФ Якщо врахувати, що AG0 окиснення пальмітинової кислоти складає 9791 кДж/моль, то на енергію, яка запасається у фосфатних зв’язках АТФ, припадає 3965 кДж (30,5 • 130), тобто 40%. 6. БІОСИНТЕЗ ЛІПІДІВ ► Біосинтез тригліцеридів відбувається у різних органах і тканинах організму при наявності двох вихідних сполук - активного гліцерину (гліцерол-3-фосфату) та активних жирних кислот (ацетил-КоА). ► Біосинтез гліцерину відбувається з відновленням диоксиацетонфосфату - проміжного продукту обміну вуглеводів. ► Хімізм біосинтезу жирних кислот зворотний ЇХ Р-ОКИСНЄННЮ. При цьому важливу роль відіграють ацегил-КоА, малоніл-КоА, НАДФ-Н+Н+, іони гідрокарбонату натрію та магнію, а також складний поліферментний комплекс синтезу жирних кислот. ► В організмі холестерин синтезується з ацетил-КоА, джерелом якого є оцтова кислота, ацетон, оцтовий альдегід, ацетооцтова кислота та інші сполуки, які утворюються під час метаболічних реакцій.
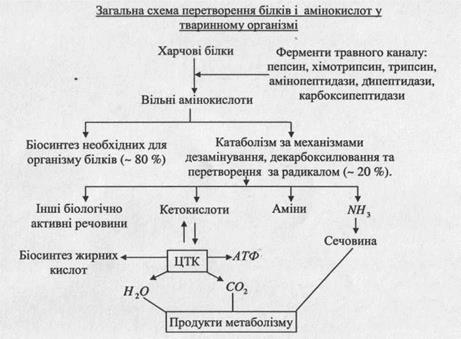
Запитання для самоконтролю 1. Класифікація ліпідів. 2. Характеристика простих та складних ліпідів, 3. Цитоплазматичні і запасні жири. їх характеристика. 4. Перетворення ліпідів у шлунково-кишковому тракті. 5. Сутність емульгування жирів. 6. Значення жовчі для перетравлювання жирів. 7. Хімізм поетапного розщеплення тригліцеридів і фосфоліпідів. 8. Схеми обміну тригліцеридів в організмі. 9. Внутрішньоклітинний обмін ліпідів. Хімізм окиснення жирних кислот і гліцерину. 10. Хімізм окиснення жирних кислот, енергетичний ефект цього процесу. МОДУЛЬ З Тема 12. БІЛКОВИЙ ОБМІН 1. Перетравлювання білкових речовин у шлунково- кишковому тракті. 2. Катаболізм білкових речовин в організмі. Хімізм перетворень амінокислот. 3. Детоксикація аміаку в організмі людини. 4. Синтез білків. Література: [1,2,3,4,6,8]. Нові поняття, терміни: перетравлювання білків, гідроліз, пепсин, трипсин, ентерокіназа, карбоксипептидази, амінопептидази, хімозин, хімотрипсин, дезамінування, декарбоксилювання, переамінування, азотний баланс, ген, триплети, кодон, антикодон, цистрон, комплементарність, трансляція, рекогніція, ініціація, елонгація, термінація, процесінг, інтрон, білкова недостатність. 1. ПЕРЕТВОРЕННЯ БІЛКОВИХ РЕЧОВИН У ШЛУНКОВО-КИШКОВОМУ ТРАКТІ Основним шляхом перетворення білків їжі є їх гідроліз (перетравлювання) до амінокислот. В організмі постійно відбувається катаболізм і анаболізм білків. Засвоєння білків залежить від кулінарної обробки, активності протеолітичних ферментів, амінокислотного складу білків. Біологічно повноцінними є білки раціону, із 100 г яких може бути синтезовано 100 г білків організму. Закон мінімуму Лібіха: якщо співвідношення незамінних амінокислот у складі білків відрізняється від оптимального на 20 %, то всі інші амінокислоти будуть також використовуватися на 20 % менше.

► Продукта гідролізу білка - амінокислоти всмоктуються в кінцевій частині дванадцятипалої і на початку тонкої клубової кишок і попадають у кров, а звідти - до клітин різних органів та до печінки. !! Амінокислоти, які не всмокталися в тонкій кишці, а потрапляють у товсту кишку, піддаються різним перетворенням під дією ферментів мікроорганізмів. Цей процес дістав назву гниття білків. При цьому найбільш поширене декарбоксилювання та деякі інші види перетворень, які призводять до утворення з амінокислот токсичних речовин: амінів, індолу, скатолу, фенолу, крезолу.
! Токсичні продукти розкладу білків із товстої кишки частково всмоктуються у кров, попадають у печінку, де знешкоджуються. 2. КАТАБОЛІЗМ БІЛКОВИХ РЕЧОВИН В ОРГАНІЗМІ. ХІМІЗМ ПЕРЕТВОРЕНЬ !! Амінокислоти до клітин надходять двома основними шляхами: після перетравлювання за рахунок реакцій переамінування з метаболітів вуглеводного та ліпідного обмінів ► Метаболічні перетворення амінокислот у клітинах організму відбуваються переважно як синтез білків і пептидів з амінокислот. Крім того, ряд амінокислот є попередниками утворення сполук непептидної природи (пуринових і піримідинових основ, біогенних амінів, нікотинової кислоти, порфіринів, в тому числі гема, тощо). Основним органом метаболізму амінокислот є печінка.
Дезамінування за 2 - 4 типами більш властиве грибам та рослинам Біологічне окиснення амінокислот в організмі людини відбувається двома щляхами: —► пряме дезамінування (за хімізмом першої реакції) —► непряме, яке ще має назви трансдезамінування або переамінування (аміногрупа переноситься на кетокислоти) R-CH-COOH + СН3 - С - СООН ч=± R - С - СООН + СН3 - СН - СООН I II II І NHj О О NH, вільна амінокислота ПВК кетокислота аланін Процес переамінування принципово ділиться на 2 етапи: 1) перенесення аміногруп з вільних амінокислот на кетокислоти, які є ключовими метаболітами (акцептори аміногруп - піруват, оксалоацетат, а-кетоглутарат). Реакції каталізуються відповідними - амінотрансферазами, кофакторами яких є похідна вітаміну В6 - піридоксальфосфат. !! Мета першого етапу переамінування - зібрати аміногрупи вільних амінокислот, що підлягають біологічному окисненню, у амінокислоти одного типу (глутамінову кислоту). 2) процес окиснення глутамінової кислоти, який відбувається у мітохондріях під дією глутаматдегідрогенази. н І НООС-СН2 -СН2-С-СООН + НАД* + н2о <------ *■ т2 глутамінова кислота НООС-СНг-СНг-С-СООН + ЫН,+НАДН + Н* О а-кетоглутарова кислота
► Продуктами обміну амінокислот є карбонові кислоти, гідроксикислоти, кетокислоти, частина яких використовується під час синтезу нових речовин, а інша частина піддається Р- окисненню, окисненню в трикарбоновому циклі Кребса до кінцевих продуктів - Н20 і С02. ! Аміни, що утворюються під час декарбоксилювання, мають високу біологічну активність, тому їх називають також біогенними амінами. ► Тканинними гормонами або нейрогормонами є серотонін, гістамін. Серотонін регулює функції нервової, серцево- судинної та м'язової систем, тиск крові. Бере участь у регуляції роботи органів дихання, травного каналу. Гістамін викликає секрецію соляної кислоти в шлунку, виявляє специфічну дію на нервові закінчення судин, зумовлюючи їх розширення і зниження тиску крові. ► у-аміномасляна кислота відіграє важливу роль у функціональній діяльності центральної нервової системи. 3. МЕТОДИ ЗНЕШКОДЖЕННЯ АМІАКУ В ОРГАНІЗМІ ЛЮДИНИ ► Аміак, який утворюється як кінцевий продукт розщеплення амінокислот, є токсичною речовиною (шкідливо впливає на центральну нервову систему, порушує процеси тканинного дихання). Тому аміак миттєво нейтралізується з утворенням нетоксичних для організму сполук. !! Одним із важливих методів знешкодження аміаку є взаємодія його з аспарагіновою і глутаміновою кислотами: ------------------ j^CxeMa^epcTBopemia^MiaKyJ ----- ► синтез глутаміну та аспарагіну ----- >. синтез амінокислот ----- ► синтез сечовини (є основним шляхом для людини) ----- ► синтез креатину * утворення амонійних солей
► При взаємодії аспарагінової та глутамінової кислот з аміаком утворюються відповідні аміди. Обидві реакції відбуваються за участю енергії АТФ. Аспарагінова і глутамінова кислоти у клітинах зв'язують аміак. ! Аміак у складі аспарагіну і глутаміну надходить у печінку, де з нього синтезується сечовина, яка є кінцевим продуктом азотистого обміну уреотелічних тварин (більшості хребетних).
Орнітин знову може вступати в реакцію з карбамоїлфосфатом. Цикл повторюється. Більшість ферментів орнітинового циклу знаходяться в мітохондріях клітин печінки. Сечовина виділяється з клітин печінки в кров, переноситься в нирки і виділяється з організму з сечею. 4. СИНТЕЗ БІЛКІВ Біосинтез білка - це багатоступеневий ферментативний процес в органелах живих клітин - рибосомах, локалізованих у цитоплазмі, який забезпечує постійне оновлення білків тканин та органів. ► Всі білки організму людини малого та середнього віку оновлюються за 135 - 150 днів. ► Протягом 1 секунди в організмі синтезується 3 млн. еритроцитів, а в кожному з них міститься біля 300 молекул гемоглобіну. ► Синтез молекули білка у живій клітині завершується протягом 2-3 секунд. !! Синтез білка відбувається за матричним принципом. Матрицею, що несе інформацію про первинну структуру білка, є ІРНК, яка утворюється при транскрипції — переписуванні послідовності чергування триплетів певних ділянок ДНК - цистронів або структурних генів. Ген складається з тринуклеотидів або триплетів, які називаються кодонами. Відповідно до кодонів молекули ДНК формуються кодони ІРНК за правилом комплементарності (відповідності). Інформація з ІРНК реалізується при трансляції на рибосомному апараті клітин (полісомах), де послідовність триплетів ІРНК перетворюється у послідовність амінокислотних залишків синтезованих молекул білка. Генетична інформація передається за формулою: транскрипція трансляція _ ДНК* --------------- -- ІРНК *~ ----- — Білок
► Рекогніція - процес сполучання амінокислот з відповідними тРНК (відбувається активування амінокислот та перенесення їх як аміноацил-тРНК з цитоплазми до місця синтезу білка - рибосом: Фермент + АТФ —» Фермент - АМФ - ФФ; Фермент - АМФ ~ ФФ + Амінокислота —> Фермент - АМФ ~ Амінокислота + тРНК —► Аміноацил ~ тРНК + АМФ + Фермент ! Трансляція - це синтез білка в рибосомному комплексі клітини. ► Ініціація трансляції - процес утворення функціонально активної рибосоми (ініціюючого комплексу).
Функціонально активна рибосома містить 50S + 30S субодиниці, ІРНК + тРНК, в якій кодон ІРНК зв’язаний водневими зв’язками з тРНК. ► Елонгація трансляції (подовження нарощування пептидного ланцюга) забезпечується факторами елонгації та відповідними аміноацил-тРНК, комплементарними кодону ІРНК, який знаходиться в рибосомі. Ці фактори разом з аміноацил-тРНК доставляються в А- ділянку рибосоми, де утворюються водневі зв’язки між кодоном ІРНК та антикодоном аміноацил-тРНК. Далі відбувається транслокація комплексу у P-ділянку рибосоми. Амінокислоти залишаються, вільна тРНК видаляється з рибосомами; ІРНК пересувається в рибосомі на один кодон, який поступає у звільнену A-ділянку і процес повторюється знову.
► Термінація трансляції (закінчення синтезу поліпептидного ланцюга) відбувається при потраплянні в A-ділянку рибосоми кодону, який не кодує жодної амінокислоти (термінуючий). При цьому складноефірний зв’язок між С-кінцевою амінокислотою та її тРНК розривається і поліпептидний ланцюг білка виходить з рибосоми. ! Регуляція синтезу білків відбувається залежно від потреб організму на рівні транскрипції, процесінгу іРНК, трансляції та посттрансляційної модифікації білків. Процесінг - посттрансляційна модифікація високомолекулярних попередників цитоплазматичних РНК. При цьому видаляються некодуючі ділянки ДНК - інтрони. ► В живій клітині рибосоми утворюють рибосомальні комплекси, нагадуючи намисто, нанизане на ІРНК. ІРНК, яка програмує гемоглобін, розміщує на своїй молекулі до 5 рибосом. Види небезпеки при нестачі або надлишку білків
Запитання для самоконтролю 1. Які ферменти розщеплюють білки у шлунково-кишковому тракті? 2. Охарактеризуйте процес всмоктування амінокислот. 3. Хімізм катаболізму білкових речовин в організмі людини. 4. Яким хімічним перетворенням піддаються амінокислоти при внутрішньоклітинному обміні? 5. Які продукти утворюються при гнитті білків у товстій кишці? 6. Охарактеризуйте шляхи детоксикації аміаку в організмі людини. 7. Хімізм та особливості процесів детоксикації аміаку. 8. Які етапи біосинтезу білків в організмі існують? 9. Охарактеризуйте процес синтезу білків в організмі. МОДУЛЬ з Тема 13. ВЗАЄМОЗВ’ЯЗОК ОБМІННИХ ПРОЦЕСІВ 1. Взаємозв’язок основних видів обміну речовин. 2. Ключові та проміжні метаболіти - ланки переходу вуглеводного, білкового та ліпідного обмінів. Література: [1,2,3,4,6,8]. Нові поняття, терміни: ключові метаболіти 1. ВЗАЄМОЗВ’ЯЗОК ОСНОВНИХ ВИДІВ ОБМІНУ !! Сукупність метаболічних реакцій, які становлять гармонійний баланс нормально функціонуючого організму, обумовлена одночасним і узгодженим перетворенням, розщепленням і синтезом у клітинах організму жирів, білків і вуглеводів. Схема загальних шляхів катаболізму
Сполучною ланкою між обміном білків, вуглеводів і ліпідів є цикл трикарбонових кислот (цикл Кребса) або цикл лимонної кислоти |^Схемавзаємозв|яз^між^міном^в^^еводів^білкі^ Білки Амінокислоти і пвк (піровиноградна кислота) Ацетші-КоА Вуглеводи
2. КЛЮЧОВІ МЕТАБОЛІТИ - ЛАНКИ ПЕРЕХОДУ ВУГЛЕВОДНОГО, БІЛКОВОГО ТА ЛІПІДНОГО ОБМІНІВ ► Взаємозв’язок між процесами обміну основних харчових речовин - вуглеводів, ліпідів, білків - здійснюється через ключові метаболіти.
!! Ключові і проміжні метаболіти - це продукти метаболізму живих організмів, які є мономерами асиміляції і дисиміляції біомолекул. !! До ключових метаболітів відносяться: ПВК, ацетил-КоА, а-кетоглутарат.
Основними метаболітами, через які також здійснюються перехід обмінів білків, вуглеводів і ліпідів, є також фосфодиоксиацетон, фосфогліцеринова кислота, а також метаболіти циклу Кребса - фумарат, сукцинат (янтарна, бурштинова кислота), малат (яблучна кислота). !! Основним містком перетину метаболічних шляхів є ацетил- КоА. !! Взаємозамінність основних класів органічних сполук обмежена (8 незамінними амінокислотами, ненасиченими жирними кислотами, жиророзчинними вітамінами тощо.) Запитання для самоконтролю 1. Загальні закономірності обміну речовин в організмі. 2. Охарактеризуйте взаємозв’язок між обміном білків і вуглеводів. 3. Сутність перетворення ліпідів у білки. 4. Охарактеризуйте взаємоперетворення вуглеводів і ліпідів. 5. Охарактеризуйте поняття „ключові метаболіти”. їх значення в процесах взаємоперетворення білків, ліпідів і вуглеводів. 6. Поясніть значення ацетил-КоА в процесах обміну білків, вуглеводів і ліпідів. 7. У чому полягає суть взаємозв’язку обміну білків і нуклеїнових кислот. 8. Схема перетворення ліпідів на білки. 9. Напишіть формули ключових метаболітів. СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ 1. Кучеренко М.Є., Виноградова Р.П. Біохімія: Підруч. для вузів. - К.: Либідь, 1995.- 462 с. 2. Боєчко Ф. Ф. Біологічна хімія. - К.: Вища шк., 1995. - 538 с. 3. Филиппович Ю.Б. Основы биохимии. - М.: Высш. шк., 1985. -503с. 4. Комов В.П., Шведова В.Н. Биохимия: Учеб, для вузов. - М.: Дрофа, 2006. - 638с. Додаткова 5. Капрельянц Л. В. Біохімія // Конспект лекцій для студ. заочного факультету. - Одеса: ОНАХТ, 2005. - 92с. 6. Боєчко Ф. Ф., Боєчко Л. О. Основні біохімічні поняття, визначення і терміни: Навч. посібник. - К.: Вища шк., 1993. - 528 с. 7. Екологічна біохімія: Навч. посібник / В.М.Ісаєнко, В.М. Войціцький, Ю.Д. Бабенюк та ін. - К.: Книжк. вид-во НАУ, 2005.-440с. 8. Дуденко Н.Ф., Павлоцкая Л.Ф., Кривоносое М.Ф., Кратенко Р.И. Биологическая химия. -X.: Прапор, 1999. - 320с. 9. Овчинников Ю. А. Биоорганическая химия. - М.: Просвещение, 1987. - 815 с. 10. Химический состав пищевых продуктов / Под ред. И.М. Скурихина, В.В. Шатерникова. - М: Пищ. пром-сть, 1984. - 240 с. 11. Сарафанова Л.А. Применение пищевых добавок. Технические рекомендации. 6-е изд., испр. и доп. - СПб.: ГИОРД, 2005. - 200с. 12. Смоляр В.И. Рациональное питание. - К.: Наук, думка, 1991. - 356 с. 13. Химический состав пищевых продуктов / Под ред. А.А. Покровского. -М.: Пищ. пром-сть, 1976. - 227 с. Структура ДНК —► Первинна структура визначає біологічні властивості ДНК і обумовлена якісним співвідношенням і послідовністю нуклеотидів у ланцюзі (Е. Чаргафф у 1950 р. сформулював 4 правила щодо основних закономірностей кількісного вмісту азотистих основ у ДНК) [2] Вторинна структура - 2 праворуч закручених антипаралельних ланцюги (хелікс), фіксованих водневими зв’язками між комплементарними парами азотистих основ (А= =Т, Г = = Ц). У залежності від параметрів (числа пар на виток, крок та діаметр спіралі) розрізняють А -, В -, С -, Z - форми ДНК. * Третинна структура - утворюється при суперспіралізації молекули ДНК. Наприклад, при довжині ДНК хромосоми людини 8 см, її спіралізована форма вміщується у хромосомі довжиною 5 нм. ------------------------ 1 Значення метаболізму Розщеплення складних органічних сполук до простих метаболітів з виділенням енергії. Перетворення екзогенних сполук на попередники біополімерів. Синтез біополімерів з використанням енергії. |












 ліноленова (<а-3)
ліноленова (<а-3)



 ► Ефіри стеролів (циклічних спиртів) і вищих жирних кислот.
► Ефіри стеролів (циклічних спиртів) і вищих жирних кислот. холестерин
холестерин
 Моногалактозилдиацилгліцерол Дигалактозилдиацилгліцерол
Моногалактозилдиацилгліцерол Дигалактозилдиацилгліцерол










 де
де






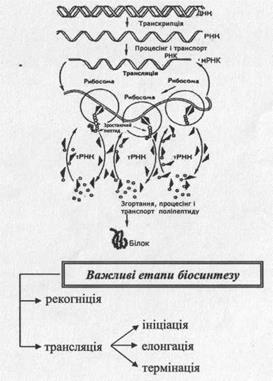
 Функціонально-активна 70 S-рибосома
Функціонально-активна 70 S-рибосома




