ПОЗНАВАТЕЛЬНОЕ
| Проведення перекристалізації
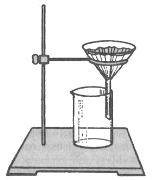
Перекристалізації з розчину Перекристалізація— один з найважливіших методів очищення твердих речовин як у лабораторних, так і в промислових умовах. Він ґрунтується на тому, що розчинність твердих сполук в гарячих розчинниках набагато вище, ніж в холодних, а також на розходженні в розчинності різних речовин в одному і тому ж розчиннику. Перекристалізацією можна очистити речовини, розчинність яких істотно зростає з підвищенням температури. При цьому домішки, що містяться в основній речовині або добре розчиняються в обраному розчиннику, або навпаки, залишаються нерозчиненими. Якщо розчинність домішок більше розчинності основної речовини, то після проведення перекристалізації, основна речовина буде осаджуватись у вигляді кристалів, а домішки залишаться в маточному розчині. Після відфільтрування кристалів отримують основний продукт, вміст домішок у якому менше, ніж до очищення. Коли розчинність домішок менше розчинності основної речовини, то при нагріванні основний продукт переходить в розчин, а домішки, що залишились нерозчинними відфільтровують (гаряче фільтрування). При охолодженні маточного розчину (фільтрату) випадають кристали основної речовини, вміст домішок у яких менше, ніж у вихідній неочищеній речовині. Іноді неочищена речовина містить домішки, які розчинні в даному розчиннику в дуже невеликій мірі і тому частково випадають в осад разом з основною речовиною. Тоді достатньо чисту речовину вдається отримати тільки шляхом багаторазової перекристалізації (дробна кристалізація). Розчинення - це фізико-хімічний процес взаємодії газу, рідини або твердої речовини з рідиною (розчинником), в результаті якого утворюється розчин у вигляді прозорої гомогенної рідини. При цьому під впливом молекул рідини відбувається розподіл розчиненої речовини по всьому об'єму розчинника. Цей процес протікає до певної межі насичення. Розчин, який знаходиться в рівновазі з розчиненою речовиною і містить максимально можливу кількість цієї речовини при даній температурі, називається насиченим розчином. У насиченому розчині встановлюється динамічна рівновага, при якій за одиницю часу стільки ж молекул переходить в розчин, скільки й виділяється з розчину. У насиченому розчині при даній температурі міститься максимально можлива кількість речовини. Концентрація насиченого розчину служить мірою розчинності речовини за даних умов. Гранична розчинність речовини при даній температурі характеризується коефіцієнтом розчинності, який показує число грамів речовини, що розчиняється в 100 г розчинника при даній температурі. У ненасиченому розчині міститься менше речовини, а в пересиченому – більше, ніж у насиченому розчині. Вперше пересичені розчини отримав Т.Є. Ловіц (1794 р.). Це розчини, що мають більшу концентрацію розчиненої речовини, ніж насичений розчин при тих же умовах. Вони можуть бути отримані повільним охолодженням насичених розчинів. Пересичені розчини термодинамічно нестійкі. Введення в них кристала розчиненої речовини або перемішування сприяють випаданню надлишку речовини з розчину. На швидкість розчинення впливає ступінь подрібнення речовини, що розчиняється. Зі збільшенням ступеня подрібнення збільшується поверхня контакту між рідкою і твердою фазами, що прискорює процес. Вибір розчинника. Успіх кристалізації залежить від правильного вибору розчинника. Розчинник, що використовується для кристалізації, повинен володіти такими властивостями: а) бути хімічно інертним по відношенню до речовини, яку очищають, як при кімнатній температурі, так і при температурі кипіння розчину; б) розчинність речовини у вибраному розчиннику повинна значно збільшуватися при нагріванні , а при охолодженні - зменшуватися; в) розчинник повинен добре розчиняти домішки навіть при низькій температурі, або практично не розчиняти їх при кипінні; г) розчинник повинен легко видалятися з поверхні кристалів при промиванні, або при висушуванні. Для вибору розчинника користуються довідковими даними про розчинність речовини, яку очищають, або проводять підбір дослідним шляхом. У пробірку поміщають кілька кристаликів речовини і додають 2-3 краплі розчинника. Якщо речовина добре розчиняється при кімнатній температурі, то даний розчинник не підходить для очищення від розчинних домішок, але може бути використаний для очищення від нерозчинних домішок. У разі, коли розчинення при кімнатній температурі йде погано, пробірку обережно нагрівають до повного розчинення проби. Якщо після охолодження випадають кристали, то розчинник придатний для перекристалізації. Бажано, щоб температура кипіння розчинника була на 10-15°С нижче температури плавлення речовини. В іншому випадку речовина може виділитися у вигляді масла (розплаву). Речовина в підсумку виходить більш брудною, ніж до перекристалізації. Якщо речовина дуже низькоплавка і не вдається підібрати відповідний розчинник, то розчинення потрібно вести при більш низькій температурі, ніж температура плавлення речовини, і виділяти речовину сильним охолодженням розчину. Коли не вдається підібрати індивідуальний розчинник, кристалізацію проводять з суміші розчинників. Для складання суміші, як правило, вибирають два розчинника: «хороший» (добре розчиняє речовину) і « поганий» (в якому речовина не розчиняється). Речовину розчиняють при нагріванні в «доброму» розчиннику, а потім зменшують її розчинність, додаючи до гарячого розчину по краплях «поганий» розчинник до появи незникаючої каламуті. Розчинники, які використовуються в суміші, повинні добре змішуватися один з одним. Звичайно застосовуються наступні суміші розчинників: спирт - вода; спирт - бензол; спирт - крижана оцтова кислота; ацетон - вода; етер - ацетон - бензен; хлороформ - петролейний ефір і інші. При виборі розчинника керуються емпіричним правилом: «подібне розчиняється в подібному» (вуглеводні - у вуглеводнях, карбонільні сполуки - в ацетоні і т.д.). Іншими словами, для розчинення речовин використовуються розчинники з близькими або аналогічними хімічними властивостями, також враховується їх полярність, що характеризується величиною діелектричної постійної ε (значення ε приводяться в довідковій літературі), яка для різних розчинників коливається в досить широкому інтервалі (для гексану ε = 1,9, для етанолу ε = 25 і т.д.). Полярні речовини добре розчиняються в полярних розчинниках (високе значення ε) , а неполярні - в неполярних (низьке значення ε). При виборі розчинника слід враховувати його температуру замерзання, можливість регенерації після перекристалізації, токсичність і доступність. Найбільш вживані розчинники – вода, спирти, ацетон, діетиловий етер, діоксан, етилацетат, хлоровміщуючі (хлороформ, чотирихлористий вуглець, дихлоретан, хлоробензол), сірковуглець. Часто в якості розчинників застосовують аліфатичні і ароматичні вуглеводи – гексан, гептан, петролейний ефір, бензен, толуен, ксилол. З інших часто використовуваних розчинників необхідно відзначити нітробензол, ацетонітрил, диметилформамід, диметилсульфоксид і розчинники з оснóвними властивостями - піридин та хінолін. Близькими за властивостями до діетилового етеру є тетрагідрофуран (ТГФ) і діоксан. Всі розчинники характеризуються певними фізичними константами (температурою кипіння, інтервалом перегонки, густиною, показником заломлення). Очищені розчинники, що не містять воду, називають абсолютними, наприклад: абсолютний спирт, абсолютний діетиловий етер. Стимулювання кристалізації. Часто кристалічна речовина не виділяється з розчину, навіть при тривалому охолодженні. Для прискорення процесу кристалізації створюють штучні центри кристалізації. При цьому часто використовують два прийоми. 1. Введення «затравки». Цей прийом полягає в тому, що в розчин вносять кристали тої ж речовини (затравки), тобто штучно створюють центри кристалізації. Якщо чистої речовини немає, можна змочити розчином скляну паличку і різко охолодити її, помістивши в порожню охолоджувану зовні пробірку. У тонкій плівці рідини на поверхні скляної палички утворюються кристали. 2. Тертя скляною паличкою об стінки посуду. Цей прийом заключається в тому, що не оплавлену скляну паличку вносять до розчину і обережно потирають об стінки посуду. При цьому утворюється дрібний скляний пил, окремі порошинки можуть виявитися підходящими центрами кристалізації. Такими ж центрами кристалізації можуть виявитися і порошинки, що містяться в повітрі. Кристалізація завжди починається від стінок і від поверхні розчину до центру (на твердих поверхнях або на межі розділу фаз). Електричне і магнітне поля, ультразвук, інколи сильне охолодження (наприклад, в рідкому азоті) – все це сприяє процесу кристалізації. Фільтрування Операція механічного відокремлення твердих і рідких компонентів суміші називається фільтруванням. У деяких випадках для відокремлення твердих частинок від рідини досить злити рідину з осаду. Цей процес називається декантацією і застосовується у випадках, коли в порівняно великій кількості рідини знаходиться небагато твердої речовини, яка легко осідає на дно. При необхідності повного розділення фаз застосовують фільтрування. Звичайно його проводять через лійку, в яку вкладають складчастий фільтр на 1 см нижчий за її краї (рис. 1). Рис. 1. Прилад для фільтрування - конічна лійка із складчастим фільтром.
Такий вид фільтрування використовують для відділення великодисперсних осадів або в разі подальшого використання фільтрату (маточного розчину). Перші мутні порції фільтрату повторно переносять на фільтр. У тих випадках, коли фільтрування потрібно провести швидко і якщо в звичайних умовах воно викликає труднощі, користуються фільтруванням під вакуумом. Сутність його полягає в тому, що в приймачі створюють зменшений тиск, в наслідок чого рідина фільтрується під тиском атмосферного повітря. Чим більша різниця між атмосферним тиском і тиском у приймачі, тим швидше йде фільтрування. Найпростіший прилад для фільтрування у вакуумі складається з лійки Бюхнера і колби Бунзена (рис. 2), яка за допомогою вакуумної гумової трубки з'єднується з запобіжною склянкою (ловушкою), а склянка — з вакуум-насосом. Колба Бунзена представляє собою товстостінну (інакше при роботі вона може бути розчавлена атмосферним тиском) конічну колбу з боковим отвором для з'єднання з водоструйним вакуум-насосом. Воронка Бюхнера відрізняється від звичайних скляних воронок тим, що вона має плоску пористу перегородку, на яку укладається паперовий фільтр. Запобіжна склянка попереджає можливість перекидання води з водоструйного насоса в колбу Бунзена. Важливо, щоб розмір лійки для фільтрування відповідав кількості осаду, а кристали цілком покривали фільтр не занадто товстим шаром.
Рис. 2. Прилади для фільтрування у вакуумі:1 — лійка Бюхнера; 2 — колба Бунзена Рис. 3. Прилад для фільтрування малої кількості речовини
Перед початком фільтрування дно лійки покривають попередньо підігнаним і змоченим розчинником паперовим фільтром. Крім фільтрувального паперу, зараз використовуються і фільтри із синтетичних матеріалів, перевага яких полягає у високій механічній міцності, термостійкості і стійкості до дії агресивних середовищ. Колбу з лійкою для фільтрування приєднують за допомогою вакуумного гумового шланга до вакуумного насоса і заповнюють лійку сумішшю, що фільтрується. Наприкінці фільтрування осад на фільтрі віджимають за допомогою плоскої скляної пробки доти, поки не припиниться відділення маточного розчину. Щоб видалити залишки маточного розчину, кристалічну речовину на фільтрі ретельно промивають невеликими порціями чистого розчинника (краще попередньо охолодженого), підключають вакуум. Осад переносять на фільтрувальний папір і висушують. Для фільтрування невеликої кількості речовини застосовують лійки Хірша з відсмоктуючими пробірками (рис. 3), лійки зі скляним «цвяшком». Перелічені прийоми фільтрування частіше використовуються, якщо цільовим продуктом є кристалічний осад. У присутності сильних лугів і кислот, ангідридів, окисників, які руйнують звичайний фільтрувальний папір, застосовують лійки з пористими скляними фільтрами (рис. 4).
Рис. 4. Скляні фільтри
Рис. 5. Лійки для гарячого фільтрування: а — з паровим обігрівом, б —з обігрівом гарячою водою; в — з електричним обігрівом
Рис. 6. Фільтрування при охолодженні
Для фільтрування гарячих розчинів при перекристалізації іноді використовують лійки з обігрівом (рис. 6). Лійки з оболонкою, заповненою льодом або охолоджувальними сумішами (рис. 7), застосовують при фільтруванні охолоджених розчинів речовин, розчинних при кімнатній температурі. Температура плавлення Температура плавлення (Тпл) є найважливішою константою, що характеризує тверду речовину. Температурою плавлення сполуки називають температуру, при якій його кристалічна фаза знаходиться в рівновазі з власним розплавом. Температура плавлення відповідає температурі, при якій тиск пари над твердим речовиною дорівнює тиску пари над рідиною. Визначити температуру плавлення можна в процесі плавлення або в процесі кристалізації розплаву. Так, якщо виключено переохолодження, то температура кристалізації збігається з температурою плавлення. Зазвичай під температурою плавлення мають на увазі інтервал температур між появою перших крапель рідини і повним переходом твердої речовини в рідкий стан. Для чистих індивідуальних речовин цей інтервал вимірюється частками градуса. Точніше визначити температурний інтервал плавлення можна шляхом повторного плавлення зразка після його застигання. Присутність домішок, як правило, знижує температуру плавлення речовин. Якщо випробуваний зразок плавиться при більш низькій температурі, ніж наведена в літературі для даної речовини, це вказує на недостатню його чистоту. При очистці речовини, температуру плавлення необхідно визначати після кожної стадії його очищення, наприклад після кожної перекристалізації. Якщо послідуюча перекристалізації вже не призводить до підвищення температури плавлення і вона збігається з наведеною в літературі, то речовина вважається цілком чистою. Додатковим критерієм чистоти речовини може служити також температурний інтервал, в якому відбувається плавлення. Так, якщо чисті продукти повністю розплавляються в межах 0,5 – 1,0оC, то сильно забруднені речовини не мають чіткої температури плавлення і при нагріванні перетворюються в рідину поступово, в межах декількох градусів. Однак це правило справедливо не завжди, тому не слід робити висновку про якість продукту лише на підставі температурного інтервалу плавлення. Якщо температури плавлення двох досліджуваних зразків близькі або збігаються, цей факт ще не може служити доказом того, що вони являють собою одну і ту ж речовину. Для більш надійного встановлення їх ідентичності визначають температуру плавлення змішаної проби. Суміш готують, ретельно розтираючи приблизно рівні кількості однієї та іншої речовини на годинниковому склі. Депресія температури плавлення, тобто зниження температури плавлення суміші у порівнянні з Тпл вихідних зразків однозначно вказує на те, що вони являють собою різні речовини. Відсутність депресії (суміш плавиться при тій же температурі, що і вихідні сполуки) служить доказом ідентичності речовин за умови, що інші константи обох речовин (наприклад, положення п’ятен на тонкошаровій хроматограмі) також збігаються. Винятки спостерігаються, наприклад, у тих випадках, коли досліджувані речовини вступають в хімічну взаємодію один з одним, утворюючи нову сполуку з більш високою температурою плавлення. Депресії в цьому випадку може і не спостерігатися, хоча суміш приготовлена з різних речовин. Практично рекомендується всі три проби - двох чистих речовин та їх суміші - плавити одночасно на одному приладі. Таким чином різницю виявити легше. При використанні капілярного методу конструкція приладу повинна дозволяти одночасне введення трьох капілярів. Слід зазначити, що визначення температури плавлення з метою попередньої ідентифікації речовин дає надійні результати лише в тих випадках, коли речовини плавляться без розкладання . Щоб переконатися в стійкості сполуки при плавленні, їй дають закристалізуватися і розплавляють ще раз. Якщо повторне плавлення відбувається при тій же температурі, отриманому результату можна довіряти. Температура плавлення речовин, нестійких при нагріванні, не є постійною величиною. Вона значною мірою залежить від умов визначення - швидкості нагрівання, кількості речовин, наявності кисню повітря і іншого. Практично розкладання речовини починається ще до того, як вона розплавиться. Продукти розкладання дають депресію з основною речовиною, внаслідок чого температура плавлення виявляється нижчою від істинної. При строгому дотриманні сталості умов визначення можна домогтися задовільного відтворення результатів. У таких випадках допускається використовувати температуру плавлення з розкладом для характеристики речовини. Слід тільки мати на увазі, що точність отриманих цифр дуже відносна і вони справедливі тільки для обраних конкретних умов визначення. Якщо розкладання обумовлено окисненням речовини киснем повітря, температуру плавлення визначають в атмосфері інертного газу або у вакуумі. За допомогою вимірювання тільки температури плавлення не можна скласти остаточного судження про чистоту випробуваного зразка або про ідентичність двох зразків. Для отримання більш надійного заключення слід скористатися даними елементного аналізу (порівнюють результати експериментального визначення процентного вмісту елементів, що входять до складу даної речовини, з обчисленим за хімічною формулою), а також різних фізико-хімічних методів (тонкошарової хроматографії, УФ- та ІЧ– спектроскопії, ЯМР, та ін). Найбільш поширеним з усіх методів визначення температури плавлення органічних речовин є визначення температури плавлення капілярним методом. Для цього невелику кількість тонко розтертого і добре висушеного препарату поміщають у запаяний з одного кінця тонкостінний капіляр, який прикріплюють до термометра і поміщають в нагрівальний блок. Використовують капіляр довжиною 45-50 мм, діаметром 1,0-1,2 мм для безбарвних речовин і 0,8-1,0 мм для забарвлених. Для воскоподібних і волокнистих речовин можна використовувати капілярні трубки трохи більшого розміру. При заповненні капіляра його відкритий кінець кілька разів вдавлюють в порошкоподібну речовину, поміщену на годинникове скло. Після цього капіляр кілька разів вдаряють заповненим кінцем об поверхню столу. Наповнений капіляр кидають запаяним кінцем вниз 10-15 разів через скляну трубку висотою 800 мм і діаметром 15-20 мм, поставлену вертикально на скляну або кахельну пластину, до ущільнення речовини в шар 2-3 мм. Температуру плавлення гігроскопічних речовин визначають у капілярах, запаяних з обох кінців; при цьому капіляр повинен бути занурений цілком в нагрівальну баню (нагрівальний блок). Капіляр закріплюють на термометрі гумовим колечком (кільце відрізане від відповідного за розмірами гумового шланга). Проба речовини повинна перебувати на рівні ртутного резервуара термометра. В звичайних умовах нагрівання при переході з твердого стану в рідкий в капілярі можна спостерігати такі явища: усадка речовини (стовпчик речовини змінює свою форму, стискаючись і відстаючи від стінок капіляра, без видимого переходу в рідкий стан); запотівання (на внутрішній поверхні капіляра з'являються крапельки рідини, речовина спікається, не втрачаючи своєї зв'язності); часткове плавлення (в капілярі поряд з твердими частинками утворюється меніск рідини по всьому перетину капіляра). Після цього, за трохи вищої температури настає стан повного розплавлення. Температуру плавлення (топлення) здебільшого відзначають по термометру, коли речовина повністю розплавилась, утворивши прозорий розплав. Щоб уникнути досить великих і часом недостатньо надійних поправок на виступаючий стовпчик ртуті, рекомендується застосовувати укорочені термометри з набору ТЛ-6 (за Аншютцем). Деякі органічні речовини плавляться з розкладанням (поява забарвлення , виділення газу). Температура розкладання зазвичай нечітко виражена і часто не може бути точно відтворена. Визначення температури плавлення в капілярах може бути виконано дуже точно, якщо попередньо приблизно визначити температуру плавлення речовини, як сказано вище, а потім капіляр з речовиною помістити в прилад, нагрітий на кілька градусів нижче цього приблизного значення. Відомо кілька конструкцій приладів для визначення температури плавлення капілярним методом. Найбільш простим з них є прилад ПТОП (рис. 1.1). Цей прилад складається з круглодонної колби на 100-150 мл з горлом довжиною 90 мм і діаметром 30 мм. У колбу наливають на 2/3 її обсягу теплоносій, в якості якого використовують концентровану сірчану кислоту , парафінове або силіконове масло.
Рис . 1.1 . Прилад для визначення температури плавлення ПТОП 1 - колба, 2 - теплоносій, 3 - пробірка, 4 - термометр, 5 - капіляр з речовиною, 6 - кільце для кріплення капіляра , 7 - кільце для кріплення пробірки, 8 - отвір в пробірці. У горло колби вставляють спеціальну пробірку довжиною 150 мм і діаметром близько 15 мм, яку фіксують у горловині колби спеціальним колечком з прорізом (щоб уникнути вибуху, можливого при нагріванні герметично закритого посуду); крім того, на пробірці є отвір для сполучення з атмосферою. Пробірку закривають корковою пробкою зі вставленим в неї укороченим термометром, нижній кінець якого повинен знаходитися на кілька міліметрів вище дна пробірки. Вміст колби нагрівають до температури на 10-15° С нижче передбачуваної температури плавлення препарату, вимірюючи температуру в приладі термометром, після чого в пробірку поміщають укорочений термометр з капіляром так, щоб ні термометр, ні капіляр не торкались дна і стінок пробірки. Потім продовжують нагрівати прилад, підвищуючи температуру зі швидкістю 0,5°С за хвилину. Якщо речовина в процесі плавлення розкладається, то швидкість нагріву збільшують до 2-3°С за хвилину або капіляр з препаратом поміщають в прилад, попередньо нагрітий до температури приблизно на 5 ° С нижче передбачуваної температури плавлення. Початком плавлення вважають появу першої краплі розплавленого речовини або поява меніска в капілярі, а кінцем - момент повного розплавлення речовини. Обидві температури відзначають і вважають інтервалом плавлення досліджуваної речовини. При визначенні температури плавлення речовин, що плавляться нижче 170°С застосовують порожню пробірку без колби. Сульфатну кислоту, робота з якою вимагає великої обережності, можна використовувати при визначенні температури плавлення до 250°С. Якщо концентрована сульфатна кислота набуває в процесі роботи бурий відтінок, то для знебарвлення до неї додають декілька кристалів нітрату калію або нітрату натрію. Суміш концентрованої сульфатної кислоти (7 мас. частин) і сульфату калію (3 частини) після 5-хвилинного кип'ятіння при енергійному перемішуванні перетворюється на прозору рідину, яку можна використовувати як теплоносій до 320°С (суміш гігроскопічна і її слід оберігати від потрапляння вологи). Техніка експерименту
Перекристалізація з розчину включає такі основні стадії: а) розчинення речовини при нагріванні; б) гаряче фільтрування – відділення нерозчинних домішок; в) кристалізація при охолодженні маточного розчину; г) фільтрування під вакуумом. Експериментально перекристалізацію здійснюють наступним чином: речовину поміщають в колбу зі зворотнім холодильником (рис. 1) і додають розчинник у свідомо недостатньому для повного розчинення речовини кількості. Нагрівають до кипіння. Якщо розчинником є вода, зворотній холодильник не потрібен.
Рис. 7. Колба з зворотним холодильником. Через зворотній холодильник порціями обережно додають таку кількість розчинника, щоб при кипінні вся речовина повністю розчинилась (тобто готується гарячий насичений розчин). Нагрівання ведуть на водяній бані (у разі низько киплячого розчинника) або за допомогою інших джерел нагрівання (крім відкритого полум'я). Очищення від забарвлених домішок здійснюють в присутності адсорбентів. Для цього розчин кип'ятять протягом декількох хвилин з активованим вугіллям в кількості 1-2% від кількості речовини, що перекристалізовують, до знебарвлення. Перед внесенням активованого вугілля розчин трохи охолоджують, так як з пор вугілля виділяється повітря, яке може привести до сильного спінення розчину і викиду рідини з посуду. Після додавання активованого вугілля суміш кип'ятять 5-10 хв. із зворотним холодильником, і гарячий розчин швидко відфільтровують через конічну лійку або лійку для гарячого фільтрування, використовуючи складчастий фільтр, в приймач – це може бути колба або стакан (рис. 1). Гарячий фільтрат охолоджують. При повільному охолодженні випадають крупні кристали, при швидкому - дрібні. Якщо кристали в даних умовах більше не випадають, кристалізація вважається закінченою. Кристали, що утворилися, відфільтровують. Для фільтрування під вакуумом збирають установку, що складається з фарфорової лійки Бюхнера, колби Бунзена і водоструминного вакуум- насоса ( рис. 1) . Лійку Бюхнера вставляють на гумовій пробці в колбу Бунзена і включають водоструминний насос. На пористу перегородку лійки Бюхнера укладають кружечок фільтрувального паперу, діаметр якого на 1 мм менше внутрішнього діаметра лійки. Якщо немає готового фільтра відповідного розміру, можна його вирізати з фільтрувального паперу. Для цього потрібно накласти лист фільтрувального паперу на лійку і зверху злегка натиснути долонею, а потім обрізати ножицями по утвореному відбитку. Вирізаний фільтр приміряють і остаточно підганяють до розмірів внутрішньої частини лійки. Перед початком фільтрування фільтр, поміщений на пористу перегородку лійки Бюхнера, змочують невеликою кількістю того розчину, який належить фільтрувати. При цьому фільтр щільно притискається до поверхні перегородки , що запобігає потраплянню твердої речовини в фільтрат. Слід пам'ятати , що змочувати фільтрувальний папір водою можна тільки при фільтруванні водних розчинів. Після цього, не вимикаючи насос, у лійку невеликими порціями наливають суміш, що підлягає фільтруванню. У колбі Бунзена створюється розрідження, і рідина з лійки протікає в колбу. Нові порції рідини додають у лійку періодично. Якщо осад пухкий, його ущільнюють плоскою скляною пробкою. Фільтрування закінчується з припиненням виділення маточного розчину через лійку . Відсмоктування продовжують ще деякий час для підсушування кристалів, після цього акуратно від'єднують шланг водоструминного насоса від колби Бунзена і вимикають насос. Кристалічну речовину з лійки переносять на чашку Петрі і висушують до постійної ваги. Низькоплавкі речовини сушать зазвичай на повітрі, термічно стійкі речовини можна сушити в сушильній шафі, відрегульованій на температуру нижче температури плавлення речовини на 20-50°С. Якщо речовини гігроскопічні, їх висушують звичайно в ексикаторах, простих або вакуумних, заповнених хлористим кальцієм, фосфорним ангідридом. Чистоту отриманого продукту встановлюють за його температурою плавлення в порівнянні з довідковими даними. Зазвичай процедуру перекристалізації повторюють до досягнення постійної температури плавлення.
КОНТРОЛЬНІ ЗАПИТАННЯ 1. Якими правилами керуються при підборі розчинників для перекристалізації? 2. Опишіть прийоми, що дозволяють прискорити процес кристалізації. 3. Які прилади використовуються при проведенні перекристалізації? 4. Який процес називають декантацією? 5. Назвіть основні прийоми фільтрування. 6. Що являє собою найпростіший прилад для фільтрування у вакуумі? 7. Який прилад використовують для визначення температури плавлення капілярним методом. 8. Як за температурою плавлення роблять висновок про чистоту продукту? Як визначають температуру депресії? Експериментальна частина Реактиви: Ацетанілід, бензойна кислота, саліцилова кислота, дистильована вода, хлороформ, петролейний ефір, етанол, ацетон. Прилади та матеріали: шпатель, 5 пробірок, круглодонна колба на 100 мл (або конічна колба), конічна лійка, хімічний стакан (100 мл), колба Бунзена, лійка Бюхнера, фільтрувальна папір, електрична плитка, водяна баня, скляна паличка, чашка Петрі, прилад для вимірювання Тпл капілярним методом. Завдання. Підібрати відповідні розчинники для перекристалізації ацетаніліду, бензойної кислоти чи саліцилової кислоти, провести перекристалізацію заданих речовин з обраних розчинників. Визначити температури плавлення чистих речовин. Хід роботи Дослід 1 Вибір розчинника: 1. У 5 пробірок кінчиком шпателя помістіть по пробі речовини (декілька кристаликів), і додайте не велику кількість розчинника (близько 1 мл). 2. Ті пробірки, в яких речовина не розчинилася при кімнатній температурі, нагрійте до кипіння (користуючись тримачем для пробірок) на гарячій водяній бані. При необхідності додайте ще кілька крапель розчинника, щоб вийшов прозорий розчин. 3. Охолодіть пробірки. Спостерігайте, чи випадають з отриманих розчинів кристали. Зробіть висновок про придатність розчинників для перекристалізації даних речовин, повідомте результат викладачеві. Дослід 2 Проведення перекристалізації 1. Помістіть в круглодонну колбу 2 г речовини для очищення, добавте вибраний розчинник у кількості, недостатній для повного розчинення речовини (для визначення кількості розчинника скористайтесь таблицею розчинності). 2. Якщо необхідно, під’єднайте зворотній холодильник. Нагрійте установку до кипіння розчинника. 3. Додаючи через холодильник маленькі порції гарячого розчинника, добийтеся по можливості повного розчинення речовини при кипінні. У колбі може залишитися деяка кількість нерозчинних домішок. 4. Відфільтруйте гарячий розчин, для цього використовуйте конічну лійку, нагріту в сушильній шафі, складчастий фільтр і хімічний стакан. Фільтрат залиште охолоджуватися для кристалізації. 5. Якщо після охолодження фільтрату до кімнатної температури кристалізації речовини не спостерігається, то утворення кристалів можна викликати тертям скляною паличкою об стінки посудини або внесенням «затравки» чистої речовини. Можна також спробувати охолодити розчин нижче кімнатної температури, помістивши його в холодильник або баню з льодом. Якщо кристали не утворюються і після цих дій, то, можливо, ви додали занадто велику кількість розчинника, і розчин необхідно частково упарити. 6. Відокремте кристали, що випали, від маточного розчину фільтруванням на лійці Бюхнера, підсушіть на повітрі між листами фільтрувального паперу, помістивши їх в чашку Петрі. Визначте температуру плавлення чистої речовини з використанням табличних даних (табл. 1). Таблиця 1 Температури плавлення і розчинність деяких органічних речовин
Дослід 3. |